麹菌A. oryzaeの多様な細胞形態の顕微鏡観察
山本七瀬
1. 序
麹菌A. oryzaeにおける有性生殖の可能性について実験を行う過程で、有性生殖の産物である子嚢殻に似た菌核(Sclerotium)や厚壁胞子(Chlamydospore)様構造体など、麹菌でこれまで詳細な報告がない様々な興味深い構造体を観察した。ここでは、直接有性生殖に関連のないものも含めて、特に興味深い観察結果について紹介する。
2. 材料と方法
(使用した麹菌株)
RIB40株(ゲノム解析に使用された野生型株)
RIB40派生株(niaD300 (niaD-)、NS4 (niaD- sC-)、および選択マーカー導入形質転換株など)
AO6株(MAT1-2型株)
(使用培地)
DPY培地:2% Dextrin、1% Polypeptone、0.5% Yeast Extract、0.5% KH2PO4、0.05% MgSO4・7H2O (pH 5.5)
CD培地: 0.3% NaNO3、0.2% KCl、0.1% KH2PO4、0.05% MgSO4・7H2O、0.002% FeSO4・7H2O、2% glucose (pH 5.5)
M培地:0.2% NH4Cl、0.1% (NH4)2SO4、0.05% KCl、0.05% NaCl、0.1% KH2PO4、0.05% MgSO4・7H2O、0.002% FeSO4・7H2O、2% glucose (pH 5.5)
PD培地(ポテトデキストロース培地、日水製薬)
3. 結果と考察
(1) 菌核(Sclerotium)の形態観察
菌核は有性生殖と関係する子嚢殻と外見が非常に良く似た構造体であり、その内部に子嚢胞子が含まれていれば有性世代の発見となる。
A. oryzaeでの有性生殖の有無について検討した際に、MAT1-2型株AO6において500-900 mmの黒く硬い菌核構造がDPY栄養寒天培地に多く形成された。そこで、まずこれらが有性生殖の産物である子嚢殻であるかを検討するため、実体顕微鏡を用いて観察を行った。その結果、構造体表面は黒くぼこぼこしており、内部は無色~茶色で何かが詰まった構造していることが分かったが、詳細な構造は分からなかった (Fig.1a)。

Fig.1a 菌核の形態観察
次に、リアルサーフェスビュー顕微鏡(キーエンス社製)を用いて内部の詳細な観察を行った。この顕微鏡は、細胞の固定操作をしなくても、走査型電子顕微鏡(SEM)のような像を撮影することができるものである。その結果、菌糸が密集したようなであることが分かった(Fig.1b)が、子嚢または子嚢胞子様の構造物は確認できなかった。

Fig.1b 菌核の形態観察
したがって、この構造体が不完全菌類においてしばしば構造が確認されている菌核であることが示唆された。
これまでA. oryzaeにおける菌核構造の詳細な性質および形成条件は報告されていないことから、得られた知見を以下に報告する。
[RIB40株およびその派生株]
- 暗所・通気条件において形成されやすく、暗所・密封条件でも多少形成されるが、光照射条件下では全く形成されない。
- PDおよびCD+0.0015%Met培地でよく形成され、CD培地でも形成されるが、MおよびM+0.15%Met培地ではほとんど形成されない。DPY培地では、白い菌核はよく形成されるが黒色のものはほとんど形成されない。
- AO6株ではほぼ初めから黒い菌核を形成するのに対し、RIB40株では最初は白い菌核が形成される。1-2週間程度で、その一部が頭部から徐々に黒く硬くなりAO6株で見られる菌核とよく似たものが形成された (Fig.2a)。
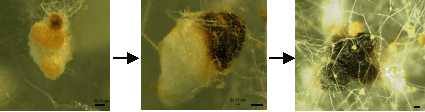
Fig.2a 菌核の形成過程
その後、一部の菌核の頭部から白い菌糸が出てくることがある (Fig.2b)。 - 菌糸の凝集構造は菌糸の寒天との接触面や空中に見られるが、黒く硬化するのは寒天との接触面に形成されるもののみで、空中に形成されるものは白色のままである (Fig. 2c)。
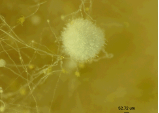
Fig.2c 菌核の形成過程

Fig.2b 菌核の形成過程
(2) 厚壁胞子(Chlamydospore)の形態観察
厚壁胞子は、多くの糸状菌が形成し、菌糸の先端やその途中に形成される、大きな亜球形で厚壁の細胞である。その壁は多くの場合メラニン性の暗色色素で着色しており、稀に無色の場合もある。厚壁胞子中には貯蔵物質がつまっており、耐久型の無性胞子と考えられているが、その生物学的機能は種によって異なる。A. parasiticusにおいては、厚壁胞子の発達時期がアフラトキシン生産の増加と関連していることも知られている5)。形成に関与する環境条件も種によって様々であるが、多くの場合栄養、湿度、光、温度、pH、空気、薬剤処理などが刺激となることが多い。厚壁胞子形成の分子的メカニズムや生物学的機能の解明が遅れており、その多くが未解明のままである。
厚壁胞子に関して、これまで麹菌においてその存在は報告されていない。RIB40派生株をM寒天培地で培養した菌糸から回収した分生子を観察する際に、しばしば大きな厚壁の細胞が混じっているのが見られた。そこで、寒天培地上の菌糸を顕微鏡で観察したところ、厚い壁に囲まれた厚壁胞子様細胞が菌糸中および菌糸先端に多く形成されているのが観察された (Fig. 3)。
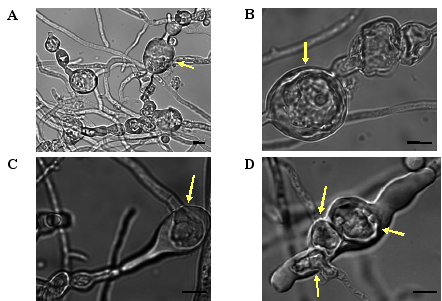
Fig.3 厚壁胞子様構造物の観察
A. 菌糸の途中や先端に20-40 mm程度の大きな厚壁細胞が見られる。
B. 厚壁胞子様構造物の内部
C,D . 厚壁胞子様構造物の内部から、新たに菌糸が伸張している様子が見られた。
Bar: 10 mm
この構造がM培地で特異的に形成されるかを調べるため、PD、CD、CD+0.0015%Met、M、M+0.15%Met寒天培地で培養した菌体についても同様の観察を行った。その結果、この構造体は通常よく使用されるPD、CD培地では見られず、M培地のみに特異的に観察されるものであることが明らかになった。よってこの構造体は、培地の酸性化やストレスに応じて形成されるのではないかと考えられた。
M培地は多分岐形態がよく観察されることが当研究室において経験的に知られている培地である。これまで詳細な観察は行われていなかったことから、コントロール株をM培地で、培養時間、炭素源、分生子濃度等を変化させ、観察を行ったところ、
・ 観察される多分岐な形態には、多分岐になる根元が膨らむものと膨らまないものとの2種類ある。
・ 多分岐は、菌糸がよく成長し菌糸密度が濃くなったカルチャーでよく観察され(全体的ではなく部分的)、植菌量を多くする、または培養時間をのばすと観察される確率が増す。
といった傾向を見出した。(培養法は、カバーガラス上の液体静置培養を用いた。)
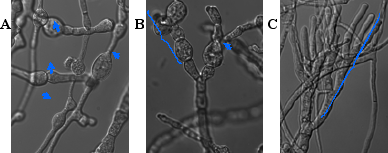
Fig.4 M培地で観察される変わった菌糸の形態
RIB40株をM培地で30℃、40 hr培養したところ、菌糸途中や、菌糸先端において膨らんだ細胞が連なった構造(A,B)、非常に多分岐な菌糸(C)など、通常見られない菌糸形態が多く観察された。
Bar:10 mm
麹菌をM培地で培養すると、寒天培養でも液体培養でも、多分岐な形態や、長い菌糸の途中に丸く大きく膨らんだ厚壁胞子様構造体など、通常の培地では見られない形態が観察された。M培地は窒素源としてアンモニウム塩を使用しており、pHが下がりやすいことが、このような形態の原因になったと推測される。pH変化は厚壁胞子が形成される環境要因の一つであることからも、その可能性は高いと考えられる。麹菌において、この構造体がどのような機能をもっているのかは不明であるが、M培地は分生子をつけにくい培地であり、その代用として厚壁胞子を形成しているのかもしれない。
(3) 菌糸融合の観察
菌糸融合は吻合(anastomosis)とも呼ばれ、糸状菌において普遍的に見られる現象であり、分生子発芽時と、成熟コロニーの菌糸先端周辺において起こることが知られている6)。前者において融合時に形成される菌糸は、特にConidial Anastomosis Tubes(CATs)と呼ばれる。接合が異なる接合型間で起こるのに対し、菌糸融合は同じ接合型間でも起こり、菌糸間での栄養物質の輸送や、菌糸ネットワークのコミュニケーションが行われていると考えられている。Aspergillus属においてもA. oryzae を含めて28種において菌糸融合が起こることが知られている7)。しかし、これまで麹菌において顕微鏡観察下での菌糸融合は確認されておらず、その形成条件等は詳しく分かっていなかった。しかし、niaD300株を、約106/100 mlの濃度でCD+0.0015%Met培地で30℃18時間培養し、顕微鏡で観察したところ、CATsと呼ばれる融合形態とよく似た分生子間の融合が起こっているのを確認した (Fig.5)。
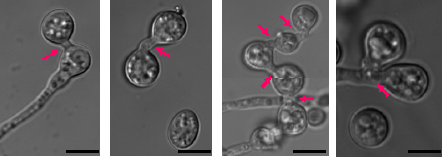
Fig.5 細胞融合
AoppgA高発現株NAFおよびコントロール株(NS4株にsCマーカーを形質転換した株)をCD+0.0015%Met培地において30℃、18時間培養したところ、分生子間が融合しているのが観察された。矢印は融合の起こっている箇所を示している。
Bar:10 mm
菌糸融合について最も研究が進んでいるN. crassaでは、S. cerevisiaeにおいて接合フェロモン応答に関与するMAPキナーゼ経路の構成要素の変異株で菌糸融合が起こらなくなることが知られている6)。これを誘導する化学誘引物質と受容体に関してはまだ解明されていないが、A. oryzaeでは、自己が分泌した接合フェロモンを自己で受容し菌糸融合に利用している可能性も考えられる。
(4) 液体培地中での分生子形成の観察
A. oryzaeは、液体培地中では分生子を形成しないといわれている。しかし、炭素源枯渇条件で長時間培養したところ、気中で形成される分生子柄とは明らかに異なる形状の分生子柄が液体中で形成されているのを見出した。RIB40株およびその由来株を、炭素源を除いたCD培地で36時間程度培養すると観察された。炭素源が枯渇しているため、分生子発芽や菌糸成長は遅くなるが、菌糸はある程度の長さ伸長したのち分生子を形成する。また、もとの植菌した分生子からは、通常の半分程度の細い菌糸と太い菌糸の両方が伸張し、分生子柄は必ず太い菌糸から形成されていた。分生子柄からメトレ等が1本しか形成されていないものや、分生子柄からまた菌糸が伸張し、その先に分生子柄を形成するものなど、不完全な形のものが多く見られた (Fig.6)。
A B C
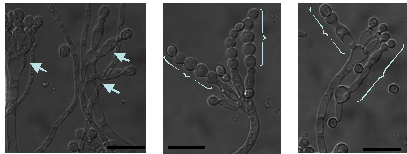
Fig.6 液体培養での分生子の形態
RIB40株を炭素源を含まないCD培地で30℃、38時間以上培養したところ、液体培養条件下においても、分生子が形成された。
Bar: 10 mm
通常、分生子頭から複数のフィアライドが形成される(A.左, B)のに対し、分生子頭がさだまっていないもの(A.右)、分生子柄からメトレ等が一本しか形成されていないもの(C)など、不完全な形のものが多く見られた。
炭素源枯渇だけでなく、栄養要求性に対して必要な物質を添加していない培地においても、菌糸が伸張し、形態的に不完全ながら分生子を形成する様子を観察することができた。このことは、A. oryzaeは栄養源が制限されていても、生活環を一回分進めることができるのを意味しており、エネルギー貯蔵力に優れていることがうかがわれる。
4. 総括
A. oryzaeは、真核微生物のなかでモデルとされているS. cerevisiaeやA. nidulansに比べ、遺伝子破壊株や高発現株を作製した際に表現型として発見するための指標となる形態の知見が非常に乏しい。そのため、生育や分生子形成が著しく阻害されるなどの顕著な性質が出ない限り、その形態が表現型であるかの判断が難しい。A. oryzaeは近年ゲノム解読が終了し、これからますます多くの遺伝子の解析が進められると予想される。したがって、A. oryzaeがどのような条件でどのような形態をとりうるのかといった知識を蓄積させることは、遺伝子機能を解明していく上で非常に重要であると考えられる。本研究で発見した様々な形態に関する知見が、A. oryzaeの遺伝子破壊株や高発現株を用いた表現型解析に役立つことを期待する。
また、有性生殖の見つかっていない麹菌では、遺伝子工学的手法が確立する以前は、菌糸融合によって生じたヘテロカリオンから擬似有性的生活環を利用して育種を行っていた8)。ヘテロカリオン形成効率の低さから、現在は遺伝子工学的手法が主流であるが、菌糸融合を誘導する条件の確立により、擬似有性的生活環を用いた細胞間組換え法の効率が上がり、育種に役立つことが期待される。
文献
1)Chang PK, Bennett JW and Cotty PJ..(2002) Association of aflatoxin biosynthesis and sclerotial development in Aspergillus parasiticus. Mycopathologia, 153, 41-48
2)Cotty PJ.. (1988) Aflatoxin and sclerotial production by Aspergillus flavus :Influence of pH. Phytopathology, 78, 1250-1253
3)Calvo, A.M., Bok, J., Brooks, W. and Keller, N.P.. (2004) veA is required for toxin and sclerotial production in Aspergillus parasiticus. Appl. Environ. Microbiol. 70, 4733-4739
4)Chang, P.K., Wilson, R.A., Keller, N.P. and Cleveland, T.E.. (2004) Deletion of the Delta12-oleic acid desaturase gene of a nonaflatoxigenic Aspergillus parasiticus field isolate affects conidiation and sclerotial development. J. Appl. Microbiol. 97, 1178-1184
5)Abou Gabal, M. and Fagerland, J.. (1981) Ultrastructure of the chlamydospore growth phase of Aspergillus parasiticus associated with higher production of aflatoxins. Mykosen. 24, 307-311
6)Gabriela Roca, M., Read, N.D. and Wheals, A.E.. (2005) Conidial anastomosis tubes in filamentous fungi. FEMS. Microbiol. Lett. 249, 191-198
7)Ishitani, C. and Sakaguchi, K.. (1955) Hereditary variation and genetic recombination in Koji-molds (Aspergillus oryzae and Asp. sojae). I. Natural variation. J. Gen. Appl. Microbiol. 50, 315-326
8)村上英也編、「麹学」日本醸造協会、1986年
Machida, M.et al.. (2005) Genome sequencing and analysis of Aspergillus oryzae. Nature, 438, 1157-1161