染色体整列から染色体一塊化まで、分裂期を通しての多様な機能
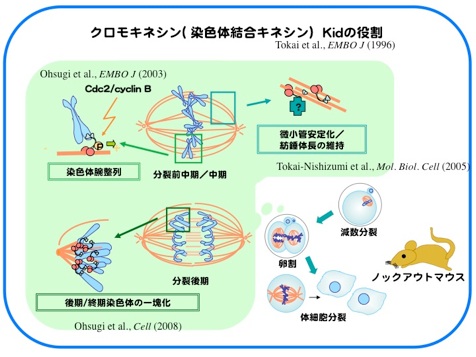
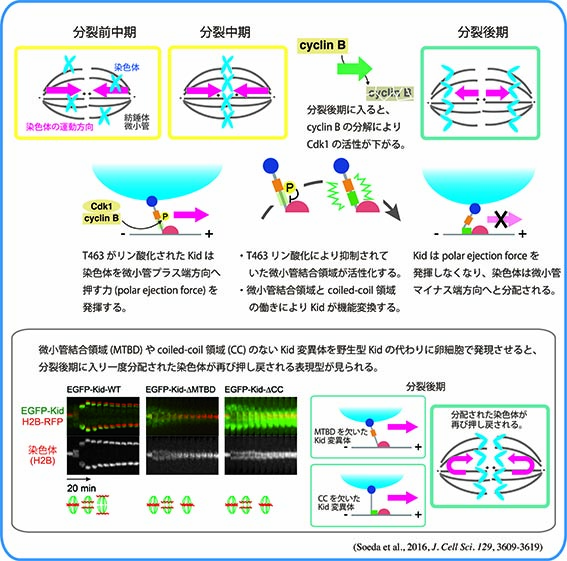
Kidは1996年に当研究室においてクローニングされた、DNA結合能をもち微小管上をプラス端方向へと動くキネシン様モーター分子です。M期には染色体と紡錘体微小管上に局在し、染色体の中期板整列や紡錘体の安定化に寄与しています。分裂中期までのKidの染色体局在には、Cdc2/CyclinBによるリン酸化や、Kidのもつ核移行シグナル(NLS)を介したImportin α/β-RanGTPase系による制御が重要であることがわかってきました。
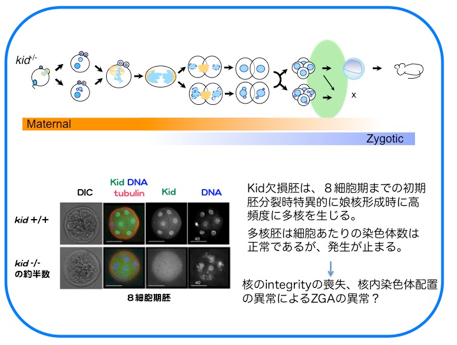
さらに、分裂後期には“分裂後期染色体コンパクション”と呼ばれる分配中の染色体をひとかたまりにする作用をもち、染色体を1つの核に収める過程を促進していることを見出しました。Kid遺伝子欠損マウスの初期胚では、分配中にまとまりきれず集団から離れてしまう染色体が高頻度に出現し、多核が形成され、約半数の胚が着床前に致死となります。Kidは体細胞においても染色体コンパクションを担っているにもかかわらず、Kid欠損による多核化は受精後の雌前核形成時と数回の卵割分裂時にのみ見られました。このことから、卵細胞に蓄積された母性因子依存的な分裂期の正常な核形成には特にKidによる染色体コンパクションを必要としていることが示唆されました。(Ohsugi et al., Cell 2008)