研究紹介
2. 母性遺伝:性の起源とオルガネラの遺伝様式
ミトコンドリアや葉緑体の多くは母性遺伝します。しかし、それがなぜ母親からなのか考えてみれば不思議です。真正粘菌は性が雌雄に二極化される前の原生生物で、その交配型(性)は3つの遺伝子座の複対立遺伝子で決まるので、遺伝的には極めて多くの性があることになります。それでもミトコンドリアは片親遺伝します。藻類も原生生物に分類されますが、その性は同型配偶子においても明らかに雌雄に二極化しており、異型配偶子を経て卵と精子による生殖へと進化します。ヒラアオノリ(Ulva compressa)を用いて最初の雄(♂)と雌(♀)とは何だったのかを明らかにしようと考えています。
- ミトコンドリアDNAの選択的消化
- 真正粘菌とその生活環
- 真正粘菌Physarum polycephalumの交配型
- ミトコンドリアDNAの相対的な遺伝パターン
- matAヒエラルキー:ミトコンドリアDNAの遺伝パターン
- 制限-修飾モデルはmatA ヒエラルキーを説明できるか?
- 雌雄性:2極化した性の進化
- オオハネモの雌雄性とオルガネラの遺伝様式
- 続きます。お楽しみに・・・
2-1. ミトコンドリアDNAの選択的消化

葉緑体が母性遺伝することはよく知られています。葉緑体の母性遺伝に関しては、その1枚で葉緑体の母性遺伝機構の全てを物語るような写真が撮られています。1982年のことで、Natureの表紙になっています。それは、当時岡崎の基生研にいた黒岩先生がクラミドモナスの接合過程で撮ったもので、クロロフィルの自家蛍光で赤く見える右側の葉緑体のDNA(白い点)がなくなっているのが分かります。
Kuroiwa, T., Kawano, S., Nishibayashi, S. and Sato, C.: Epifluorescent microscopic evidence for maternal inheritance of chloroplast DNA. Nature 298: 481-483 (1982)
ミトコンドリアでこれに匹敵する写真を撮りたいとずっと思っていました。粘菌のミトコンドリアならば、核様体が発達しているので、雄(♂)のミトコンドリアのDNAが消失すると迫力のある写真が撮れるはずです。核様体はDNAが蛋白質によって高次に組織化された構造体です。核膜はありませんがミトコンドリア核(mt核)とも呼びます。
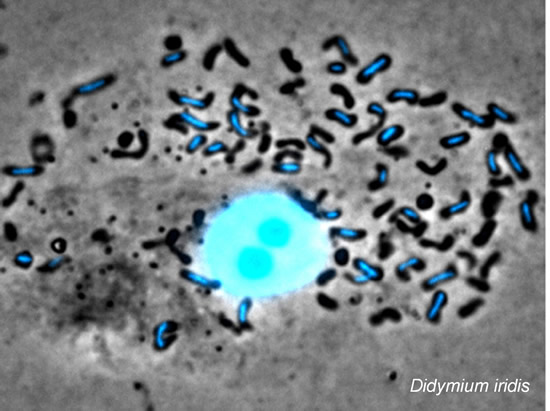
上の写真がその1枚で、これは真正粘菌Didymium iridis(ゴマシオカタホコリ)の接合子です。DNA特異的な蛍光色素DAPIで染色して位相差蛍光顕微鏡で観察しています。細胞の中央にあるのが核で、雌雄の配偶子(粘菌アメーバ)に由来する核が融合して1つになっています。この頃になると、約60個あるミトコンドリアの中で、雄(♂)由来の約30個のDNAが分解され核様体が消失してしまいます。同様の観察はPhysarum polycephalum(モジホコリ)でもなされています。D. iridisでも、P. polycephalumでも、DNAが残っているのは雌(♀)由来のミトコンドリアだけなので、ミトコンドリアは必然的に母性遺伝することになります。
参考文献
- Moriyama, Y. and Kawano, S.: Rapid, selective digestion of mitochondrial DNA in accordance with the matA hierarchy of multiallelic mating types in the mitochondrial inheritance of . Genetics 164: 963-975 (2003).
- Moriyama, Y., Yamazaki, T., Nomura, H., Sasaki, N. and Kawano, S.: Early zygote-specific nuclease in mitochondria of the true slime mold. Curr Genet 48: 334-343 (2005).
- Moriyama, Y., Itoh, K., Nomura, H. and Kawano, S.: Disappearance of mtDNA during mating of the true slime mold Didymium iridis. Cytologia 74: 159-164 (2009).
- Moriyama, Y. and Kawano, S.: Maternal inheritance of mitochondria: multipolarity, multiallelism and hierarchical transmission of mitochondrial DNA in the true slime mold . J. Plant Res. 123, 139-148 (2010)
2-2. 真正粘菌とその生活環

真正粘菌は変形菌とも呼ばれ、変幻自在で捉えどころのない変形体やキノコのミニチュアのような小さな子実体を作るのでコレクターもたくさんいます。南方熊楠や昭和天皇も変形菌に魅せられた一人です。
Physarum polycephalum(モジホコリ)やDidymium iridis(ゴマシオカタホコリ)は、実験室内でもその全生活環を容易に培養できることから、モデル生物として古くから研究されています。倍数体期は多核の変形体で、108個もの核が5分内外の誤差で同時に分裂します。P. polycephalumは、1960年代から1970年代にかけて、細胞周期の研究に頻繁に利用され、ウイスコンシン大学マッカードル研究所のグループを中心に世界中に広まりました。ミトコンドリアに関しては、大型で観察しやすいこともあり、ミトコンドリアが発見された19世紀末から注目されていて、AltmonやCawdryの先駆的な研究が有名です。

図は左から、「モジホコリカビ変形体」、「モジホコリカビ子実体」、「ゴマシオカタホコリ子実体」1)、「猫楠表紙」2)、「熊楠夫妻、ご進講の際の写真」3)です。
1) 高橋和成「粘菌写真データベース」より
2) 水木しげる「猫楠―南方熊楠の生涯―」角川ソフィア文庫 (1992)
3) 中瀬喜陽・長谷川興蔵「南方熊楠アルバム」八坂書房 (1990)
真正粘菌の生活環は単核の粘菌アメーバの時期(半数体期)と多核の変形体の時期(倍数体期)からなっています。胞子から発芽した粘菌アメーバは異なる交配型のもの同士が接合し接合子となり、接合子内で細胞核は融合し、細胞分裂を伴わない細胞核分裂を繰り返し多核の変形体となります。変形体は適当な光、飢餓条件のもとで子実体を形成し、減数分裂の開始とともに胞子をつくります。真正粘菌のミトコンドリアは他の生物に比べ著しく発達したミトコンドリア核を1個もっていて、DAPI蛍光顕微鏡法を用いてミトコンドリア融合株の生活環の各時期のミトコンドリアを観察することができます。接合期のミトコンドリアDNAの選択的消失だけでなく(図中の赤矢印)、子実体形成期と接合期にミトコンドリアが融合することが分かっています。
2-3. 真正粘菌Physarum polycephalumの交配型

真正粘菌の接合は連鎖していない3つの遺伝子座(matA, matB, matC)によって制御されています。それぞれの遺伝子座はいくつもの複対立遺伝子が存在し、接合するためには異なる対立遺伝子の組み合わせになっていなければなりません。
3つの遺伝子座にはそれぞれ異なった機能があります。matC は細胞融合の際の低pHに対する耐性を決定しています。matBは、接合子形成の際の細胞融合を制御して、2つの粘菌アメーバがmatBの対立遺伝子が同じ(ホモ)だと細胞はほとんど融合しません。matAは細胞融合の後の細胞核融合を制御し、matAがホモだと核は融合しません。これまでにmatA, matB, matCの各遺伝子座にはそれぞれ少なくとも15、15、3の複対立遺伝子が見つかっているので、真正粘菌には15×15×3=675以上の性が存在することになります。
交配型でも、性でも、同じもの同士は交配しないのが原則です。菌類の交配型を支配する遺伝子には、1対のものと2対のものがあって、それぞれ「2極性」と「4極性」呼ばれています。2極性では50%、4極性では25%の確率で自家交配が抑制されることになり、子孫に遺伝子型の多様性を増大させる効果のあると考えられています。真正粘菌P. polycephalumの交配にはmatA, matB, matC3つの交配型が関与しているので、「6極性」と呼ぶこともできるかも知れません。
交配型の多極性や複対立遺伝子は自家交配を忌避するあまり不和合過多に陥るのを防ぐ原始的な仕組みの1つだろうと考えられます。子嚢菌類は2極性でMATaとMATα の2つの接合型しかもちません。しかし、担子菌類になると、ホメオボックスドメインをもつmatA遺伝子座に加えて、フェロモンないしそのレセプターをコードするmatB遺伝子座が接合には必用になります。Coprinus cinereus(ヒトヨタケ)の接合型は、複数の対立遺伝子が存在し連鎖していないmatA とmatB によって決まっていて、matAもmatBも異なっていないと正常に接合しません。野生株においていくつものそれぞれの遺伝子座に対立遺伝子が見つかっており、結果として膨大な何千もの接合型の組み合わせが存在することが分かっています。こうした仕組みも性の収斂進化の1つと考えられます。
参考文献
- Kawano, S., Kuroiwa, T. and Anderson, R. W.: A third multiallelic mating-type locus in. J Gen Microbiol 133:2539-2546 (1987).
- Kawano, S., Takano, H. and Kuroiwa, T.: Sexuality of mitochondria: Fusion, recombination, and plasmids. Int. Rev. Cytol. 161, 49-110 (1995).
- May, G. and Matzke, E.: Recombination and Variation at the A Mating-Type of Coprinus cinereus. Mol Biol Evol 12, 794-802 (1995).
2-4. ミトコンドリアDNAの相対的な遺伝パターン

多極性と複対立遺伝子は多種多様な交配型の組合せが可能になるので、ミトコンドリアDNAの遺伝パターンも単に母性遺伝や父性遺伝ということだけでは捉えがたくなります。例えば、AI35 (matA2)、 TU41 (matA12)、 DP246 (matA16)、 AI16 (matA1) をかけ合わせた場合、TU41はミトコンドリアの遺伝に関して雄(♂)にも雌(♀)にもなり(左列)、DP246×AI16では両性遺伝も見られるようになります(右列下)。ミトコンドリアDNAの遺伝パターンには、粘菌アメーバーに、AI35 > TU41 > DP246 > AI16 というような一種の階層性があるように見えます。多くの他のかけ合わせの結果から、matA 間に matA7 > matA2 > matA11 > matA12 > matA15/matA16 ≧matA1 > matA6 というヒエラルキーが存在することが分かっています。
参考文献
- Moriyama, Y. and Kawano, S.: Rapid, selective digestion of mitochondrial DNA in accordance with the matA hierarchy of multiallelic mating types in the mitochondrial inheritance of Physarum polycephalum. Genetics 164: 963-975 (2003).
2-5. matA ヒエラルキー:ミトコンドリアDNAの遺伝パターン
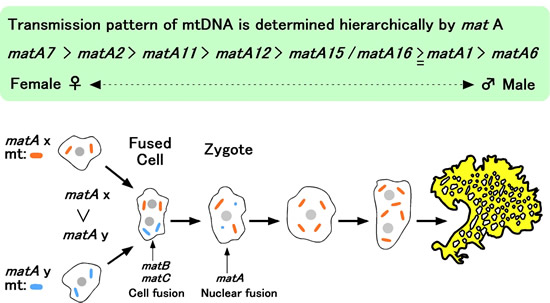
オルガネラ(葉緑体とミトコンドリア)の遺伝は交配型(性)と強く連鎖しています。母性遺伝が起こる場合、子孫にオルガネラが遺伝する方が「雌(♀)」で、遺伝しない方が「雄(♂)」ということになります。例えば、クラミドモナスの交配型では、葉緑体遺伝子を遺伝する側をmt+、遺伝しない方をmt-と当初から名づけられています。クラミドモナスの交配型は2極性で単一遺伝子ですから、雌(♀)と雄(♂)あるいは母親と父親は一義的に決まってしまいます。
一方、真性粘菌の場合、ミトコンドリアの供与体(母親)になるには交配型(matA)に一種の階層性(ヒエラルキー)があることが分かっています。中位の粘菌アメーバは、上位の粘菌アメーバと交配したときはミトコンドリアを供与することはできませんが、下位の粘菌アメーバと交配したときにはミトコンドリア供与体として振る舞うことができます。このヒエラルキーはmatA遺伝子と関連しており、例えば、 上位、AI35 (matA2) > 中位、 TU41 (matA12) > 下位、 AI16 (matA1)という関係があります。これまでに、8つのmatA遺伝子に関しては、matAのヒエラルキーが明らかになっていて、 matA7 > matA2 > matA11 > matA12 > matA15/matA16 ≧ matA1 >matA6 となっています。
参考文献
- Kawano, S., Anderson, R. W., Nanba, T. and Kuroiwa, T. (1987) Polymorphism and uniparental inheritance of mitochondrial DNA in Physarum polycephalum. J Gen Microbiol133: 3175–3182.
- Kawano, S. and Kuroiwa, T. (1989) Transmission pattern of mitochondrial DNA during plasmodium formation in Physarum polycephalum. J Gen Microbiol 135: 1559–1566.
2-6.制限-修飾モデルはmatAヒエラルキーを説明できるか?
数理モデルを用いてmatAヒエラルキーを説明しようとする試みがなされています。九州大・理学府の岩永と佐々木(2004)は2つのメカニズムの可能性ついて検討しています。一つはそれぞれの粘菌アメーバで抑制因子(核酸分解酵素?)の発現が異なるレベルにあるとする"Sppression-power model"で、もう一つは非メチル化部位で部位特異的にmtDMAを切断する制限酵素が関連したミトコンドリアDNA分解を促進するとする"Site-specific nuclease model"です。両方のモデルでmatAヒエラルキーが交配型遺伝子座と抑制因子遺伝子座の間に強い非平衡連鎖が成り立つ結果として進化することが分かっています。
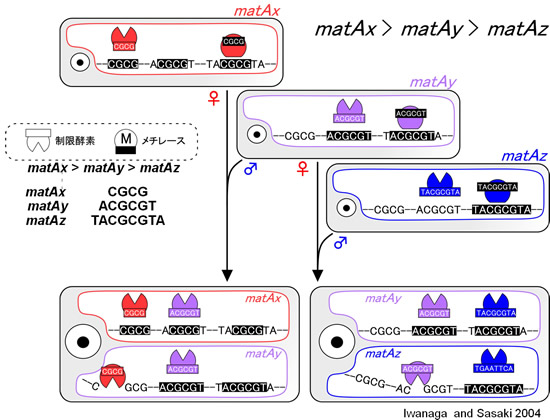
数理モデルは取っ付きにくいので、私たち独自の解釈も含めて、"Site-specific nuclease model"を模式図にしました。鯉のぼりのように見えるのは粘菌アメーバで、目のように見えるのは核で黒目の部分が核小体を表しています。身体というか鱗が描かれる部分がミトコンドリアになります。
アイデアの要は制限-修飾モデルでそれぞれの認識配列を入れ籠構造にしたことです。これによって制限と修飾に階層性をもたせることが可能になりました。制限-制限酵素モデルにおいては、粘菌アメーバはそれぞれの認識配列をもっており、2つの粘菌アメーバが接合したときに自分の制限酵素によって相手の認識配列を切断します。一方、自分の認識配列はメチル化して、相手からはもちろん自分自身の制限酵素からも保護する必要があります。
例えば、matAxとmatAyが接合したときは、matAxの制限酵素はCGCGという配列を認識して接合相手のDNAを切断しようとし、matAyの制限酵素はACGCGTという配列を認識して接合相手のDNAを切断しようとします。こうした制限酵素は認識部位が同じメチル化酵素と必ずペアになっているので、matAxのメチル化酵素はCGCGが含まれる配列をすべてメチル化してしまう。ACGCGTもTACGCGTAもメチル化されるので、matAyの制限酵素はそれらを切断することができない。一方、matAyのメチル化酵素は自分自身のもつACGCGTとTACGCGTAはメチル化できても、CGCGはメチル化することはできない。matAxの制限酵素はメチル化されていないこのCGCGを切断するので、matAyのミトコンドリアDNAのは遺伝できないことになります。同様のことはACGCGTとTACGCGTAを認識配列とするmatAyとmatAzの間でも起こることになり、入れ篭構造になった認識配列のより短いものが上位となります。
制限-修飾モデルに入れ篭構造の認識配列を仮定することで、matAヒエラルキーをスマートに説明できることが分かったが、その実験的証明はまだ十分ではありません。しかし、ミトコンドリアの片親遺伝が起る一方で、交配型が二極化していない真正粘菌は、2極化した雌雄性の起源と進化を考えるうえで極めてユニークなモデル生物になりうるのではと期待されます。
参考文献
- Iwanaga, A. and Sasaki, A. (2004): Evolution of hierarchical cytoplasmic inheritance in the plasmodial slime mold Physarum polycephalum. Evolution, 58, 710-722.
- Moriyama, Y. and Kawano, S.: Maternal inheritance of mitochondria: multipolarity, multiallelism and hierarchical transmission of mitochondrial DNA in the true slime mold Physarum polycephalum. J. Plant Res. 123, 139-148 (2010).
2-7.雌雄性:2極化した性の進化
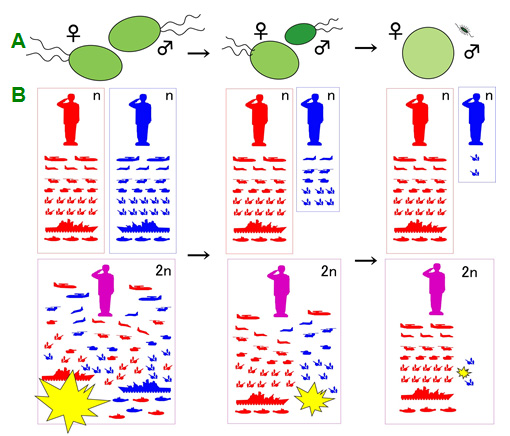
性はなぜ2つなのか? 雌雄2つの性を説明するのに「第三の性はありえない」とするのが古典的な考え方で、雌雄の違いは最初生殖細胞の大きさの違いとして生じ、中間的な大きさのものが脱落することによって2つの明らかに大きさの異なる卵と精子ができあがったとされています。しかし、ここで説明されているのは、雌雄の性差であって、卵と精子という2つの生殖細胞が生じることは説明できても、性が2つしかないことを完全には説明していません。同型配偶子は大きさが同じなのに2つの性をもっています。これは、大きさに差ができる前に性は2つに分極していることを示すもので、古典的な考えでは説明できません。
オックスフォード大学のハースト(L. Hurst) は「赤の女王」仮説で有名なハミルトン(W. Hamilton)とともに、「なぜ性は2つなのか?」という問は「なぜミトコンドリアや葉緑体といったオルガネラの遺伝子は母性遺伝するのか?」という問と同じだと考えています。雄(♂)のオルガネラは、受精の前後で除去されて、次世代に伝わることはありません。オルガネラという観点からみると、性は「オルガネラを提供する性」と「オルガネラを放棄し提供しない性」の2つしかないことになります。
問題はなぜオルガネラを提供しない性があるかということです。鍵は利己的な遺伝子のコンフリクト(競合)にあると考えられています。オルガネラ遺伝子も利己的であるとすれば、両親由来のオルガネラ間で過激なコンフリクトが起こります。オルガネラDNAは1細胞当たりの数が多いので、遺伝子コンフリクトが激しくなると接合子の生存さえ脅かされかねません。だからといって、一方の親由来のオルガネラを接合時に消去してしまおうとすると、これはこれで接合子にとって大きなダメージになります。例えば、図の左下にあるのは、J. Plant. Res.の2010年3月号の表紙です。クラミドモナスの葉緑体が母性遺伝するところを生きたまま撮影するのに成功したときの写真ですが、上の写真から下の写真への30分ほどの間に雄(♂)の葉緑体DNAがほぼ完全に消失しているのがわかります。
これを回避する最も有効な手立ては一方的に雄(♂)がオルガネラを放棄することです。こうした一方的な軍備縮小こそ、遺伝子コンフリクトの軍拡競争から種を守る最良の方法なのです。オルガネラ間の競合が減って接合子の適応度が増せば、その種にとっては極めて有利となり、オルガネラを放棄する性である雄(♂)が増えることになります。雄(♂) はオルガネラを放棄することでさらに小さくなり、卵子をよりよく見つけることができるように運動能力を備えるなど特殊化するものが出てきます。それが精子です。
2極化した性の進化模式図は軍拡競争をイメージして、核を軍事パレードで敬礼する将軍、オルガネラを様々な軍備で表しています。
参考文献
- Hurst,L. and Hamilton, W.D.(1992): Cytoplasmic fusion and the nature of sexes. Proc. Roy. Soc. Lond. B. 247, 189-194.
- 河野重行:性の起源と進化.シリーズ進化学3「化学進化・細胞進化」岩波書店、pp.105-150 (2004).
2-8.オオハネモの雌雄性とオルガネラの遺伝様式
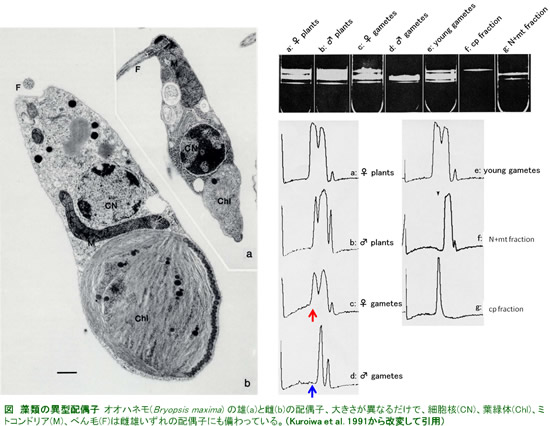
さて、現実は理論を追認するだろうか? Bryopsis maxima(オオハネモ)などのように進化した多細胞藻類は、雌雄に大小の差が生じ配偶子は異型化します。電顕写真をみると、大きさが異なるだけで、細胞核(CN)、葉緑体(Chl)、ミトコンドリア(M)、鞭毛(F)は雌雄いずれの配偶子にも備わっているのが分かります。問題は、こうした配偶子の異型化にともない、父親由来のオルガネラDNAの消失が早まる傾向があるかどうかです。
オルガネラDNAを調べるのにはPCR法などがありますが、ゲノム全体を調べるにはこうした簡便な方法よりCsCl密度勾配遠心が有効です。図の左にはオオハネモの雌雄の配偶子の全DNAの密度勾配遠心パターンが示されています。雌雄の配偶体(♀♂lants)では3つのピーク(右から葉緑体(cp)、核(N)、ミトコンドリア)が観察されますが、雌(♀)の配偶子では3つ、雄(♂)の配偶子では葉緑体DNAのピークがなくなり2つのピークしか観察されないことが分かりました。雄(♂)の配偶子は接合する前に葉緑体DNAを消失していることになります。戦争ではなく軍縮を選んだことになります。ヒラアオノリのようにほぼ同形の雌雄配偶子をもつものでは配偶子形成過程で雄(♂)の葉緑体DNAが消失することはないので、オオハネモのこの例は先の「軍縮」モデルの正当性を証明していることになります。



「オスは生きているムダなのか」とはショッキングなタイトルですが、オルガネラ遺伝という視点から雄(♂)の役割を考えていくと、雌雄性の起源と本質が見えてくるのではないでしょうか…
参考文献
- Kuroiwa, T., Kawano, S., Watanabe, M. and Hori, T. (1991): Preferential digestion of chloroplast DNA in male gametangia during the late stage of gametogenesis in the anisogamous alga Bryopsis maxima.Protoplasma, 163, 102-113.
- 池田清彦 「オスは生きているムダなのか」角川学芸出版, 193p (2010).
- マット・リドレー「赤の女王―性とヒトの進化」翔泳社、515p (1995).
- 河野重行:性の起源と進化.シリーズ進化学3「化学進化・細胞進化」岩波書店、pp.105-150 (2004).
続きます。お楽しみに・・・





