1. 光受容体(微生物型ロドプシン)の探索・構造機能解析
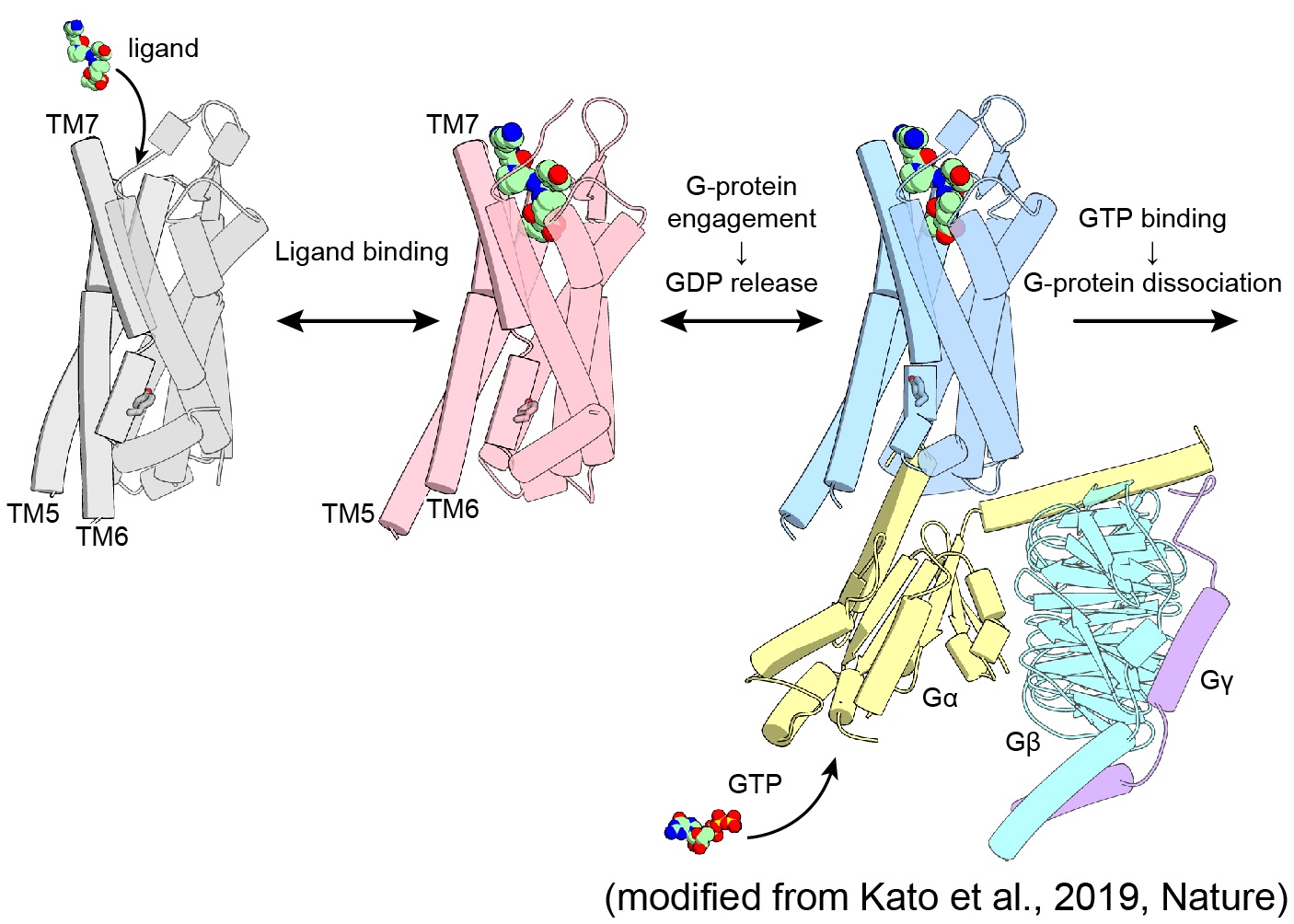
ヒトから微生物まで殆どの生物は光を受容し、その光情報やエネルギーを用いて行動しています。この光情報の受容には多くの場合、"レチナール"と呼ばれる低分子を結合した"ロドプシンファミリータンパク質"が用いられており、私たちがモノを見ることができるのも、元を正せば私たちの眼の中でこのロドプシンが光を受容してくれるためです。
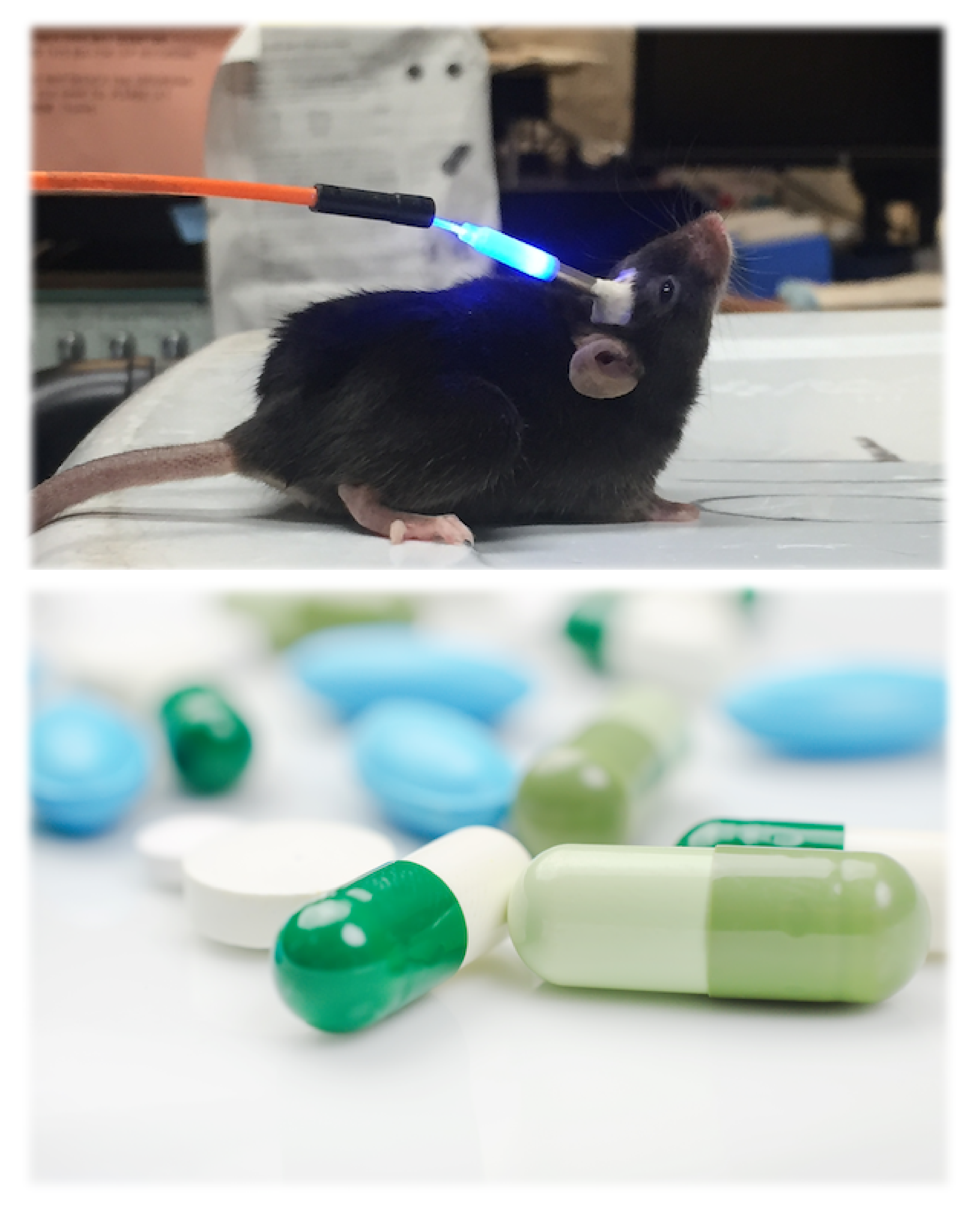
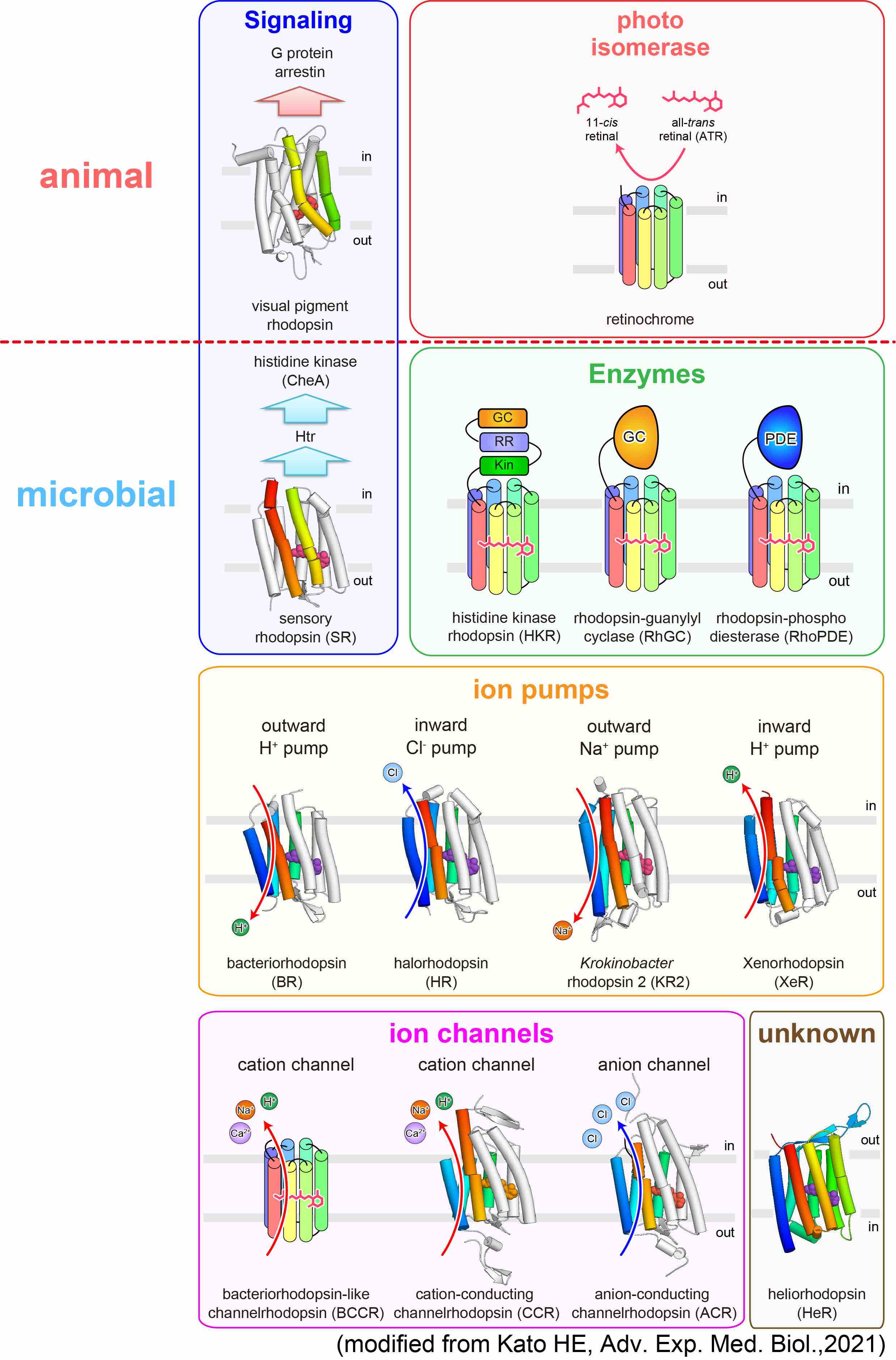
しかし、ロドプシンはヒトのような動物だけではなく様々な微生物にも存在しており、しかもその機能は動物が持つロドプシンよりも非常に多様であることがわかってきています。また、微生物が持つこうした多様なロドプシンは、近年、光を用いて生命現象(特に神経細胞の活動)をコントロールするためのツール(オプトジェネティクスツール: optogenetics tool)として利用できることが分かり、脚光を浴びています。
加藤研では、オプトジェネティクスツールの主役であるイオンチャネル型ロドプシンを中心に、様々なロドプシンタンパク質の探索・構造機能解析を行い、「なぜロドプシンは光エネルギーをイオン輸送や環状ヌクレオチドの合成分解など、様々な分子機能へと変換することができるのか」という疑問に答えを与えるべく、そのユニークな性質の分子機構について研究を行なっています。
これまでに陽イオンチャネル型ロドプシン、Na+ポンプ型ロドプシン、天然型陰イオンチャネルロドプシン、人工型陰イオンチャネルロドプシンといったロドプシンタンパク質の構造決定に成功し、構造情報に基づいた各種機能解析を行うことで、それぞれのタンパク質が持つ機能の構造基盤を明らかにしてきました。