RESEARCH
Research 1 高効率反応・新反応開発関連テーマ
実験室レベルの化合物合成から工業的な医農薬品・ファインケミカルズ合成にいたるまで広く液相有機合成がおこなわれていますが,グリーン度・資源利用効率・エネルギー効率などの観点からみるとまだまだ改善の余地が残されています。例えば,種々の有機基質の含酸素有機化合物への変換と脱水素反応に代表される酸化的官能基変換は,いまだに量論量以上のクロム,マンガンなどの酸化剤が用いられているケースがあり,毒性重金属塩の処理などの深刻な問題も抱えています。
我々は,一貫してグリーンケミストリーを指向した高効率液相有機合成,特に開発の遅れている触媒酸化反応のための高機能固体触媒の開発に関する研究に従事してきました。我々は,固体触媒の分野に新しい分子論的な設計概念を導入し,独自の視点・手法から創出したナノ構造触媒(分子性・結晶性ナノ酸化物触媒,ナノ水酸化物触媒,合金を含む金属ナノ粒子触媒,図1.1)を用いると,様々な高効率有機合成反応(ワンポット合成を含む)が実現できることを明らかにしてきました。
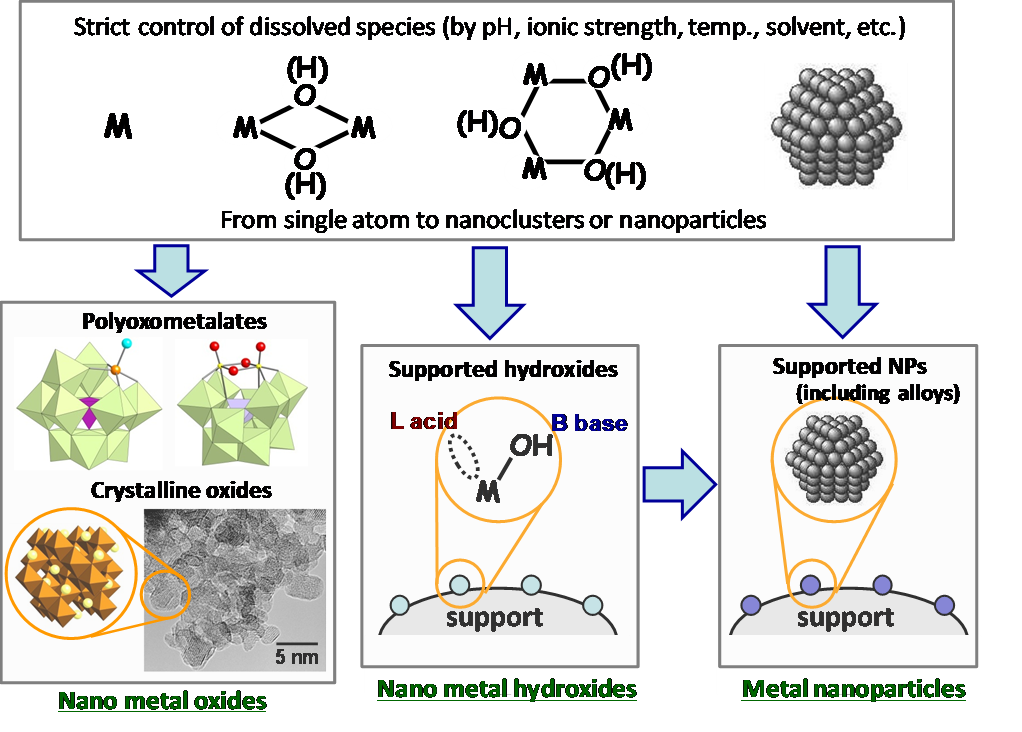
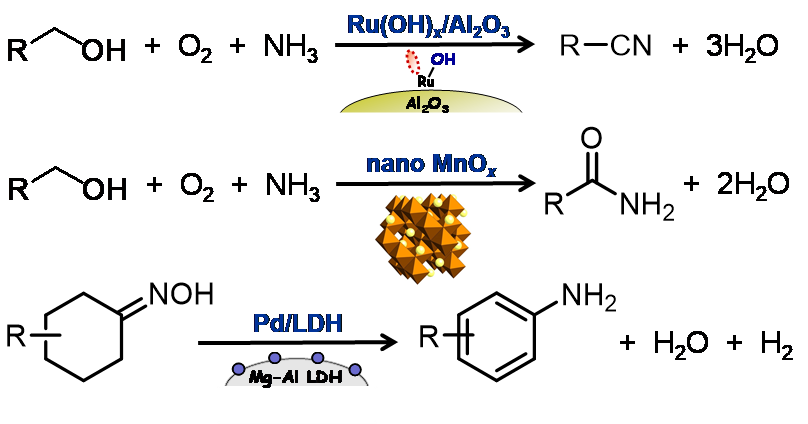
例えば,ポリオキソメタレート触媒による過酸化水素有効利用率>99%の酸素化反応(エポキシ化など)[1.1],ナノルテニウム水酸化物触媒が有するBronsted塩基とLewis酸の協奏的アルコールの活性化を利用したアンモ酸化反応[1.2](図1.2上段),結晶性ナノマンガン酸化物の酸化力・水の活性化能を利用したアルコール,アルキルアレーン,アミンなどのアミド化反応[1.3](図1.2中段)などのいくつかの環境調和型の新反応の開発に成功しています。また,パラジウム,金あるいはそれらの合金ナノ粒子の特異的脱水素能を新たに発見しています。それらの脱水素能を巧みに利用し,例えば,シクロヘキサノールからのフェノール合成[1.4],アリールアミンの選択的合成(アニリンvsジアリールアミンvsトリアリールアミン)[1.5],オキシムからのアニリン合成[1.6](図1.2下段),アゾベンゼンの選択的合成[1.7]などの種々の新しい脱水素芳香環形成反応を実現しています。最近では,安価な非貴金属のニッケルにおいても,適切にナノ粒子化した触媒を用いることで様々な脱水素芳香環形成反応が進行することを見出しています[1.8]。
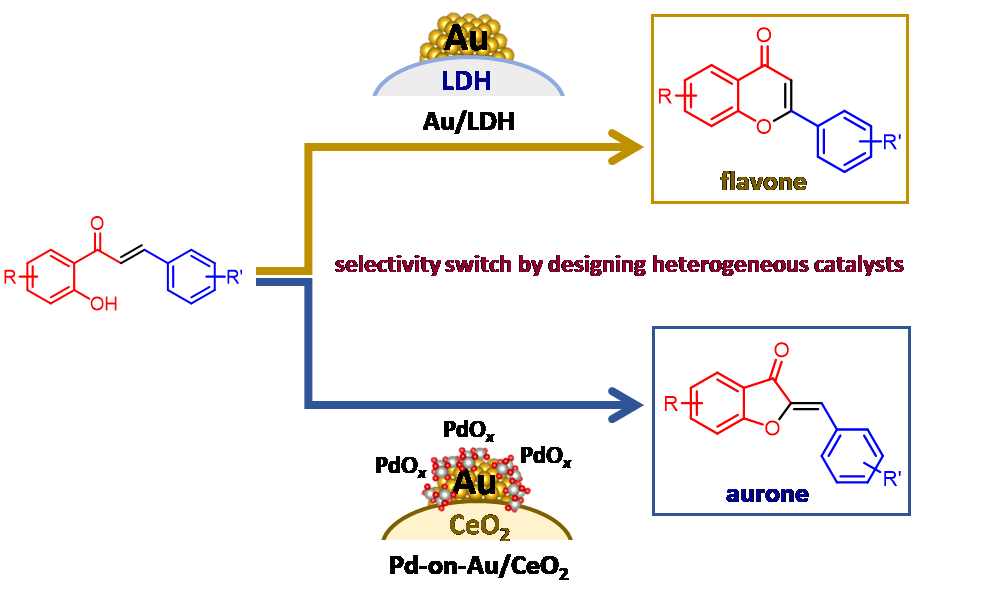
また,金ナノ粒子を塩基性水酸化物であるLDH担体に担持した機能集積型固体触媒を設計して,ヒドロキシケトンとアルデヒドからのワンポットフラボン合成を実現しています[1.9](図1.3上段)。さらに,金ナノ粒子コア・酸化パラジウムシェル構造触媒を設計すると,同じ原料からフラボンではなく,オーロンを高い選択性で合成できることも世界で初めて見出しています[1.10](図1.3下段)。このような選択性スイッチは固体触媒ならではのものです。
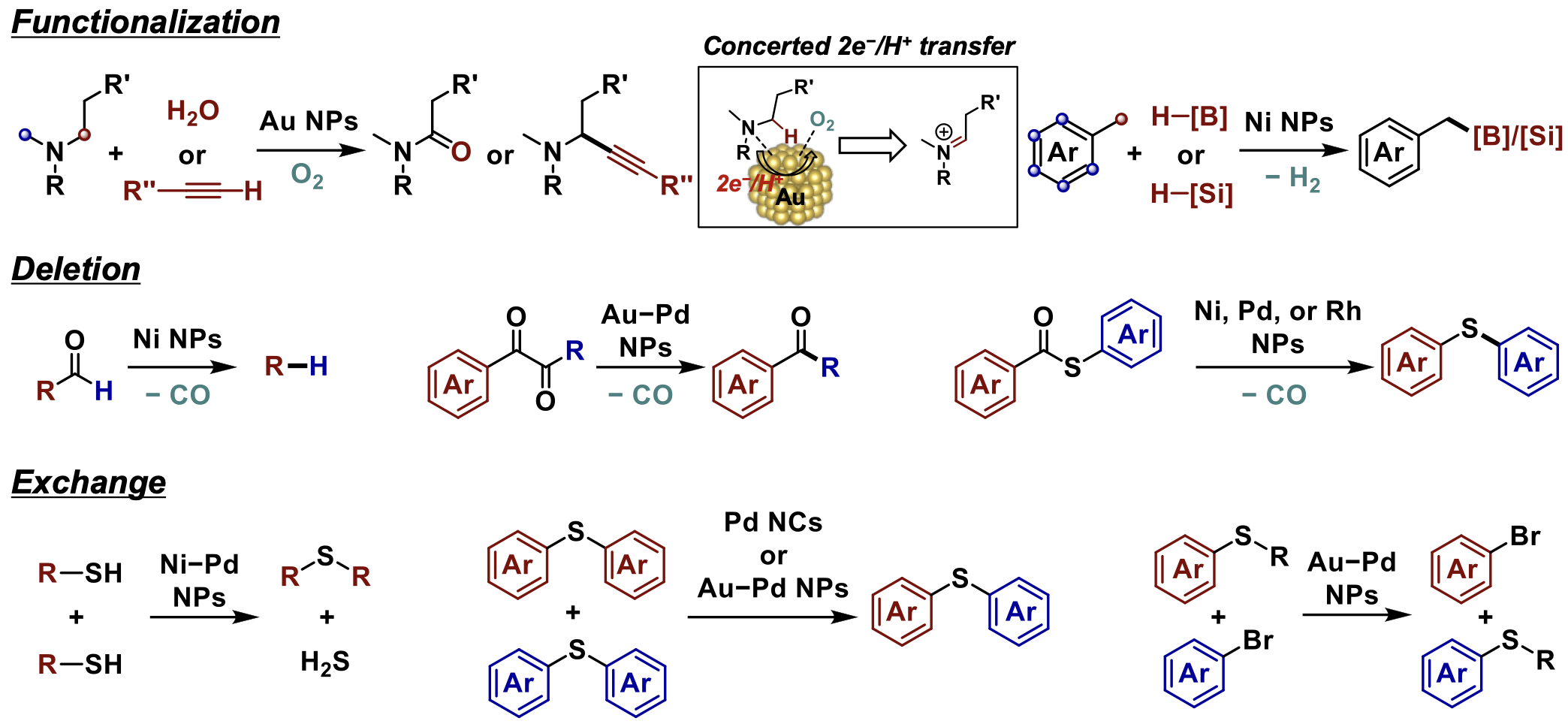
さらに最近では,汎用的・有用な構造を有する化合物を部分的に編集して効率的に機能性化合物を合成する手法の開発にも取り組んでおり,特定のC–H結合を”修飾”する反応、特定の官能基を”消去”する反応、特定の官能基を”交換”する反応、といった分子編集型の反応を様々な金属ナノ粒子触媒を用いて実現しています(図1.4)。例えば,第三級アミンのα-メチレン基を位置特異的に酸化的官能基化する反応[1.11]やアルキルアレーンのベンジル位C(sp3)–H結合を選択的に脱水素ボリル化/シリル化する反応[1.12](図1.4上段),アルデヒド・1,2-ジケトン・チオエステル等のカルボニル化合物からカルボニル基を消去する反応[1.13](図1.4中段),スルフィドやチオールといった含硫黄化合物のC(sp2)–S結合切断を経るC–S/S–H,C–S/C–S,C–S/C–Brメタセシス反応[1.14](図1.4下段),などの開発に成功しています。これらの反応の多くは,金属ナノ粒子触媒特有の多点活性化が鍵になっていると考えられ,例えば,金ナノ粒子触媒による第三級アミンの酸素酸化では,第三級アミンと酸素分子が金ナノ粒子に共吸着した後に協奏的二電子一プロトン移動が起こるという新たなアミン酸化機構であるために,未踏のα-メチレン基位置特異性が発現したことが示唆されています(図1.4上段)。
上記の反応は,我々独自のナノ構造触媒ならびに固体表面の精密設計・機能集積化によって初めて実現した固体触媒ならではの反応です。これらの反応は,安価で入手容易な化合物を原料として使用可能,空気中の酸素を酸化剤として使用可能,アンモニアを窒素源として使用可能,副生成物が水や水素のみであるなど,従来の合成法と比べて圧倒的に環境調和型の反応といえます。これまでの固体触媒研究は,単に均一系触媒を固定化したものを既存の反応に適用し,活性や再使用性などを議論するだけの研究が数多くを占めていました。一方,我々のおこなってきた固体触媒研究は,ただ単に活性種を固定化するだけではなく,均一系触媒でも実現されていなかった新反応開発のための活性点構造の創出や機能の集積化を独自の視点・手法で行ったという点で,これまでの固体触媒研究とは一線を画すと自負しています。
References
- K. Kamata, K. Yonehara, Y. Sumida, K. Yamaguchi, S. Hikichi, N. Mizuno, Science 2003, 300, 964-966.
- T. Oishi, K. Yamaguchi, N. Mizuno, Angew. Chem. Int. Ed. 2009, 48, 6286-6288.
- (a) K. Yamaguchi, H. Kobayashi, T. Oishi, N. Mizuno, Angew. Chem. Int. Ed. 2012, 51, 544-547; (b) Y. Wang, K. Yamaguchi, N. Mizuno, Angew. Chem. Int. Ed. 2012, 51, 7250-7253; (c) Y. Wang, H. Kobayashi, K. Yamaguchi, N. Mizuno, Chem. Commun. 2012, 48, 2642-2644; (d) Y. Miyamoto, Y. Kuroda, T. Uematsu, H. Oshikawa, N. Shibata, Y. Ikuhara, K. Suzuki, M. Hibino, K. Yamaguchi, N. Mizuno, Sci. Rep. 2015, 5, 15011.
- (a) X. Jin, K. Taniguchi, K. Yamaguchi, N. Mizuno, Chem. Sci. 2016, 7, 5371-5383; (b) X. Jin, K. Taniguchi, K. Yamaguchi, K. Nozaki, N. Mizuno, Chem. Commun. 2017, 53, 5267-5270.
- (a) K. Taniguchi, X. Jin, K. Yamaguchi, K. Nozaki, N. Mizuno, Chem. Sci. 2017, 8, 2131-2142; (b) Y. Koizumi, K. Taniguchi, X. Jin, K. Yamaguchi, K. Nozaki, N. Mizuno, Chem. Commun. 2017, 53, 10827-10830; (c) Y. Koizumi, X. Jin, T. Yatabe, R. Miyazaki, J. Hasegawa, K. Nozaki, N. Mizuno, K. Yamaguchi, Angew. Chem. Int. Ed. 2019, 58, 10893-10897; (d) S. Takayama, T. Yatabe, Y. Koizumi, X. Jin, K. Nozaki, N. Mizuno, K. Yamaguchi, Chem. Sci. 2020, 11, 4074-4084; (e) W.-C. Lin, T. Yatabe, K. Yamaguchi, Chem. Commun. 2021, 57, 6530-6533; (f) H. Li, T. Yatabe, S. Takayama, K. Yamaguchi, JACS Au 2023, 3, 1376-1384; (g) W.-C. Lin, T. Yatabe, K. Yamaguchi, Chem. Lett. 2025, 54, upaf043
- X. Jin, Y. Koizumi, K. Yamaguchi, K. Nozaki, N. Mizuno, J. Am. Chem. Soc. 2017, 139, 13821-13829.
- W.-C. Lin, T. Yatabe, H. Kimura, T. Yabe, K. Yamaguchi, ACS Catal. 2025, 15, 10651-10662.
- T. Matsuyama, T. Yatabe, T. Yabe, K. Yamaguchi, Nat. Commun. 2025, 16, 1118.
- T. Yatabe, X. Jin, K. Yamaguchi, N. Mizuno, Angew. Chem. Int. Ed. 2015, 54, 13302-13306.
- T. Yatabe, X. Jin, N. Mizuno, K. Yamaguchi, ACS Catal. 2018, 8, 4969-4978.
- (a) X. Jin, K. Kataoka, T. Yatabe, K. Yamaguchi, N. Mizuno, Angew. Chem. Int. Ed. 2016, 55, 7212-7217; (b) T. Yatabe, K. Yamaguchi, Nat. Commun. 2022, 13, 6505.
- (a) D. Yoshii, T. Yatabe, T. Yabe, K. Yamaguchi, ACS Catal. 2021, 11, 2150-2155; (b) Q. Yu, T. Yatabe, T. Matsuyama, T. Yabe, K. Yamaguchi, Catal. Sci. Technol. 2024, 14, 2730-2738.
- (a) T. Matsuyama, T. Yatabe, T. Yabe, K. Yamaguchi, ACS Catal. 2021, 11, 13745-13751; (b) T. Matsuyama, T. Yatabe, T. Yabe, K. Yamaguchi, ACS Catal. 2022, 12, 13600-13608; (c) T. Matsuyama, T. Yatabe, K. Yamaguchi, Org. Biomol. Chem. 2024, 22, 579-584; (d) T. Matsuyama, T. Yatabe, K. Yamaguchi, ACS Catal. 2024, 14, 10214-10222.
- (a) K. Mitamura, T. Yatabe, K. Yamamoto, T. Yabe, K. Suzuki, K. Yamaguchi, Chem. Commun. 2021, 57, 3749-3752; (b) T. Matsuyama, T. Yatabe, T. Yabe, K. Yamaguchi, Catal. Sci. Technol. 2024, 14, 76-82; (c) T. Matsuyama, T. Yatabe, T. Yabe, K. Yamaguchi, Chem. Sci. 2024, 15, 11884-11889; (d) T. Matsuyama, T. Yatabe, K. Yamaguchi, Cell Rep. Phys. Sci. 2025, 6, 102671.
Research 2 天然炭素資源転換関連テーマ
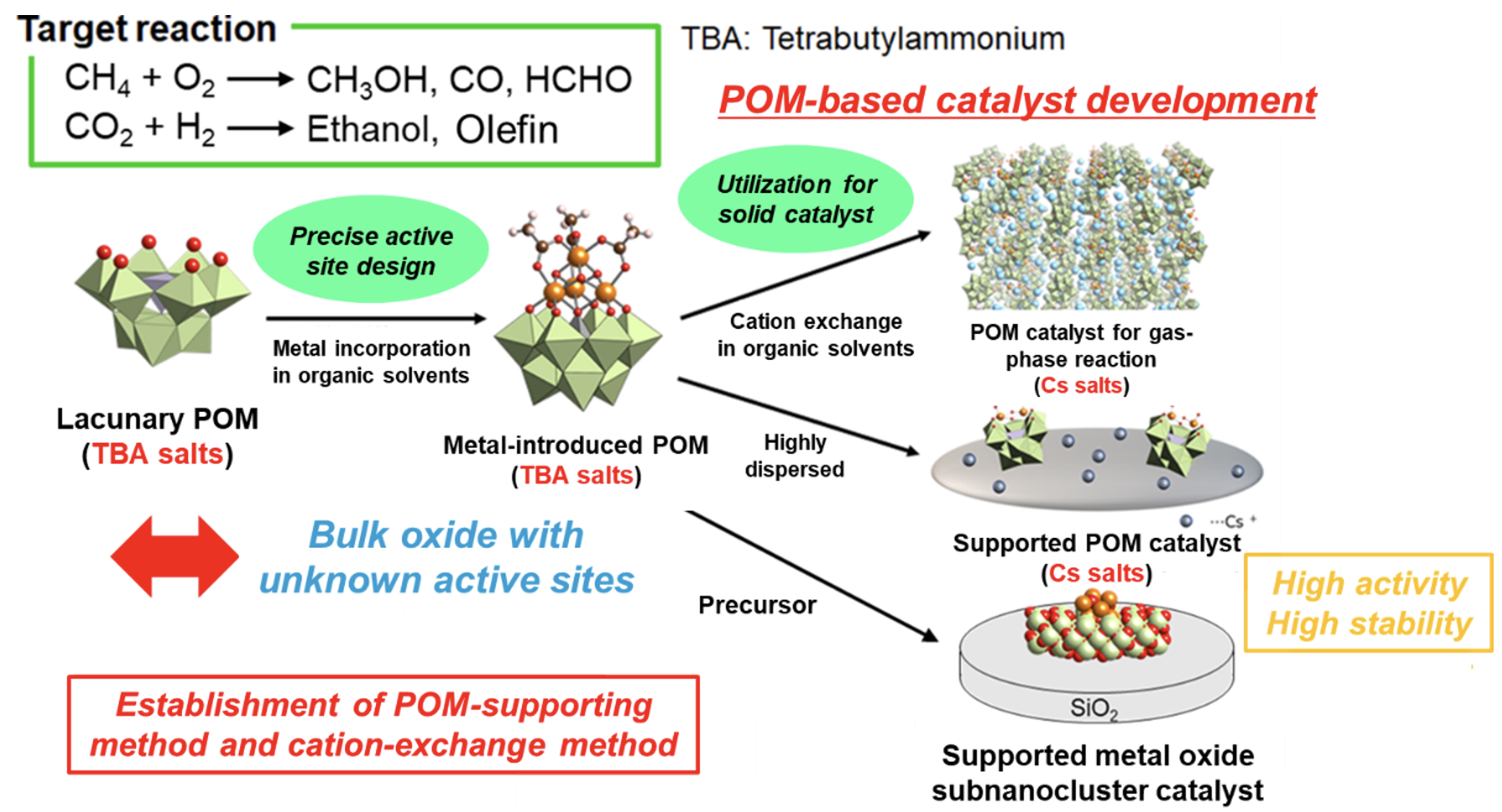
天然ガスの主成分であるメタンや未利用炭素資源の一つであるバイオマス資源などの天然炭素資源から基幹化学品を効率的に得られるようになれば,多様な天然炭素資源をバランスよく活用できる将来の産業基盤の確立につながります。我々は,触媒を用いて豊富に存在する天然炭素資源の化学的転換(特に酸化反応)に注目しています。例えば,メタンを用いた直接メタノール合成[1]や直接ホルムアルデヒド合成[2,3]では,酸素を用いてメタノールやホルムアルデヒドを合成ガス(一酸化炭素と水素の混合ガス)を経由せず一段で合成できるプロセスです。しかしながら,生成物が原料のメタンよりも反応性が高く逐次酸化を容易に引き起こすため,メタノールを高収率・高選択的に合成することは非常に高難度です。合成ガスを経由する間接転換プロセスでは,多段の熱交換器を要する大規模プラントになりコストがかかるため,直接オンデマンドに製造するグリーンケミストリー指向の省エネプロセスが望まれています。このような需要の中で、触媒開発が非常に重要なポイントとなります。ポリオキソメタレート(POM)は分子状の無機酸化物クラスターであり、構成元素に応じた高いレドックス能や無機分子鋳型としての作用など、特異な物性を有する物質です。私たちのグループでは,POMを前駆体として活用することで、天然ガス資源やバイオマス資源[4]などの炭素資源を、高効率に基幹化学品に転換可能な新規触媒開発を行ってきました。
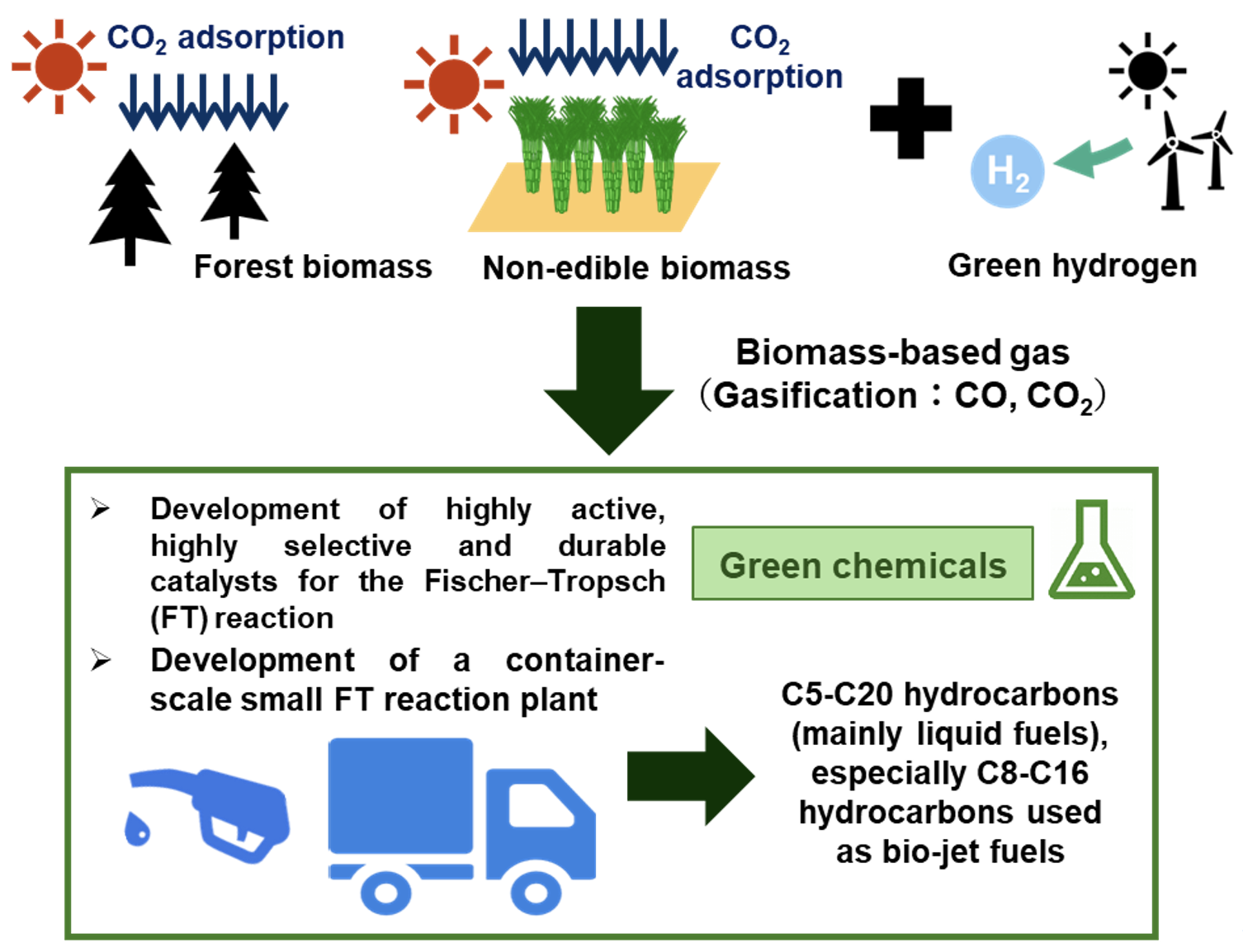
また最近では,福島国際研究教育機構(F-REI)[5]プロジェクトにおいて福島バイオマス由来の原料ガス(CO2,CO)をカーボンニュートラル炭素原料,再生可能エネルギー由来の水素を利用し,有用グリーン化学品を得る統合プロセスの研究開発を行っています。特に私たちのグループでは,高効率フィッシャー・トロプシュ(FT)反応における炭化水素(燃料)合成のための触媒開発に注力しています。一般的なFT反応は生成物炭素の分布を示すAnderson−Schulz−Flory(ASF)分布に従って様々な炭化水素が合成されるため,コバルトや鉄を構成元素とした種々のポーラス材料や複合酸化物を前駆体としてASF分布から脱し高選択的にSAFになり得る炭化水素を合成可能な新規触媒開発を行っています。さらに効率的に触媒開発を進めるために,迅速触媒評価が可能なシングルマイクロリアクターや4 MPa程度まで昇圧可能な高圧ガス流通反応装置を多数有しています。従来は,既存の触媒を用いることや膜分離・構造体触媒などの工学的手法を単に組合わせることが多いですが,私たちのグループでは原子分解能TEMをはじめとした最先端のキャラクタリゼーションや計算化学,ハイスループット高圧反応装置などを用いた多角的なアプローチから高活性な新規触媒を開発する点が他と一線を画しています。
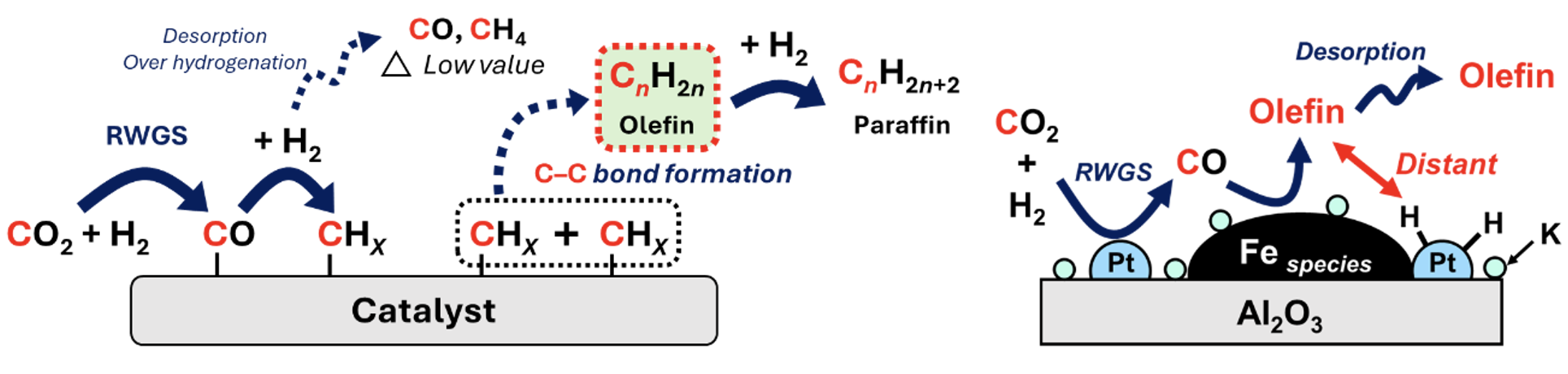
また、CO2の水素化による低級炭化水素合成の触媒開発も行っています。CO2から低級炭化水素、特に低級オレフィンを合成する触媒として、C–C結合形成に高活性な炭化鉄を利用する鉄系触媒の開発を行ってきました。CO2水素化反応は前段の逆水性ガスシフト反応(RWGS)が律速段階であり、低圧条件では貴金属の添加などが必要となります。しかしルテニウムなどの貴金属を添加した際にはメタンが生成するメタネーション反応が副反応として起こるため、酸化鉄にルテニウムナノ粒子を担持することによってCO2水素化反応中にルテニウムを酸化鉄で被覆し、メタネーションを抑制する触媒の開発に成功しています。このように低級オレフィンを収率良く得るために、鉄と異種金属からなる活性点の配置や界面を設計・利用することで水素化能や中間体吸着形態を制御した機能集積鉄系触媒の開発を行っています[6]。
References
- T. Suzuki, T. Yabe, K. Suzuki, K. Yamaguchi, Chem. Lett. 2025, 54, upaf077.
- K. Wachi, T. Yabe, T. Suzuki, K. Yonesato, K. Suzuki, K. Yamaguchi, Appl. Catal. B 2022, 314, 121420.
- K. Wachi, T. Yabe, T. Suzuki, K. Yonesato, K. Suzuki, K. Yamaguchi, Catal. Sci. Technol. 2023, 13, 4744–4752.
- T. Suzuki, T. Yabe, K. Yamaguchi, J. Jpn. Petrol. Inst. 2025, in press.
- https://www.f-rei.go.jp/
- (a) T. Hojo, T. Yabe, K. Yamaguchi, J. Jpn. Petrol. Inst. 2023, 66, 238–245; (b) T. Hojo, T. Yabe, K. Yamaguchi, J. CO2 Util. 2025, 98, 103153.


