研究内容 Research
1). 共生微生物による植物生長促進機能や植物保護機能を支える分子基盤の理解
私たちの身近な存在である植物は無数の微生物と相互作用していることが近年の微生物のメタシークエンス解析により判明しています。一方で、これまで目にみえる病気を引き起こす病原菌や菌根菌や根粒菌といったごく一部の共生菌を除いたその他の大部分の微生物は解析されておらず、その植物における役割は不明です。私たちはこれらの微生物の理解を深めることは宇宙や深海の神秘に迫る試みに劣らず興味深いことであると考えています(図1)。
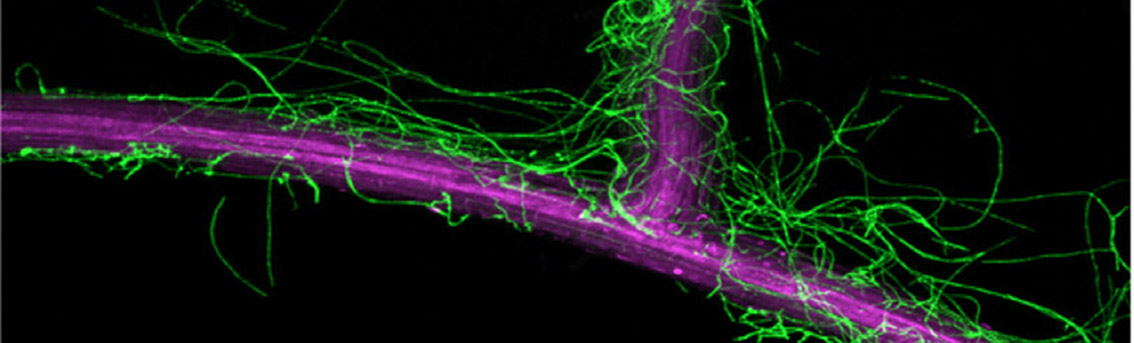
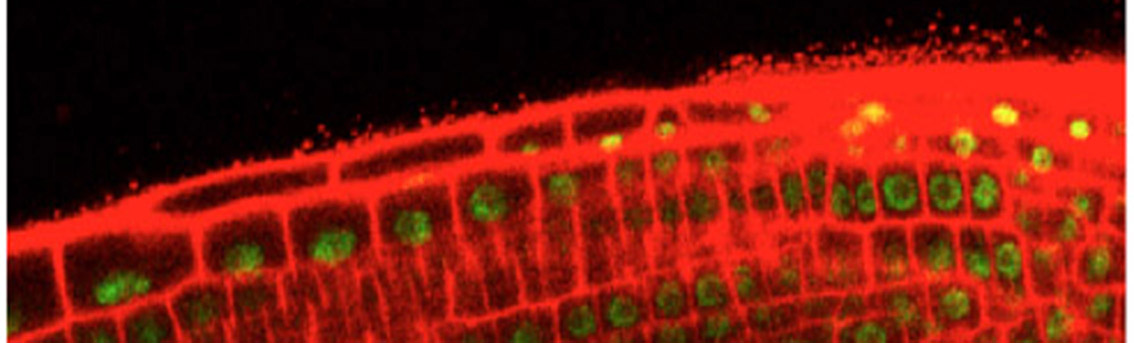
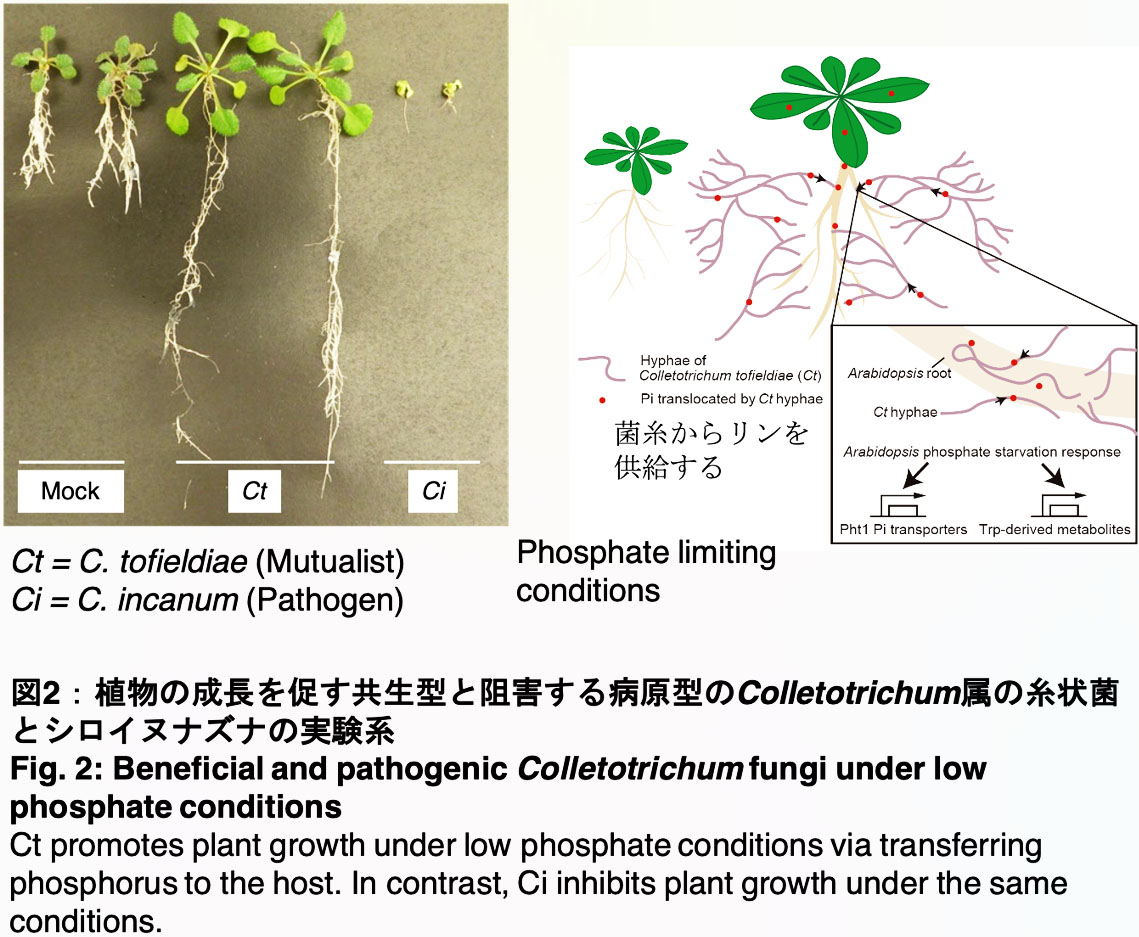
例えば、私たちはこれまでに野外のリン欠乏土壌で生育するモデル植物シロイヌナズナから単離された糸状菌Colletotrichum tofieldiae (以下Ct)がシロイヌナズナを始めとするアブラナ科植物の根に感染し、リン欠乏環境ではリンを自身の土壌中に張り巡らせた菌糸を介して運び植物に届ける、いわば、植物の第2の根として働き、その結果として、様々な植物種の植物生長を促すことを見出しています(Hiruma et al., Cell 2016; Hiruma et al., Current Opinion in Plant biology 2018,図2)。
Ct -シロイヌナズナの系の特徴として、他の類似した共生系と比較して、様々な情報がこれまで蓄積しているモデル植物シロイヌナズナを宿主植物とすることに加えて、Ctも培養が容易で相同組換え法を活用した遺伝子の破壊なども容易に行えることから、植物・菌双方向から共生効果を支える分子メカニズムを解明できることが期待できます。我々は本モデル系を中心に微生物による共生効果を支える分子機構を解明することを目指しています。さらに、リンや窒素が枯渇した自然土壌で植物が健康に生育できる謎を解き明かすために、貧栄養土壌で生育する植物の内部で生息する細菌や糸状菌の単離を様々なフィールドで行っています (図2)。
これらの中には、様々な環境下で植物の成長に寄与する有用菌なども数多く見つかってきています。これらの内生微生物による植物生長促進や植物保護能などの共生効果を支える分子基盤を明らかにしていくことは、今後持続的な農業生産を目指していく上で有用微生物を活用していくためには必要不可欠と考えています。
1) Investigating the Molecular Mechanisms Underlying Beneficial Interactions between Plants and Fungal Endophytes
1) Recently, we discovered that the root fungal endophyte Colletotrichum tofieldiae (Ct) enhances the growth of the model plant Arabidopsis thaliana under conditions of low phosphate availability by transferring phosphorus to the host (Hiruma et al., Cell 2016, Figure 2). The Ct-A. thaliana interaction represents an ideal model system for elucidating the molecular mechanisms underlying beneficial interactions between plants and fungal endophytes, given that the fungal partner is amenable to genetic manipulation, including targeted gene disruption, and that a wealth of genetic tools and resources are available for the plant host. In addition to investigating the Ct-A. thaliana interaction, we are isolating various endophytic fungi and bacteria from healthy plants grown in naturally nutrient-limited environments, with the aim of identifying additional intriguing microbial partners.

2) 比較ゲノミクスを駆使した共生菌・病原菌比較解析による微生物の共生性・病原性を規定する分子基盤の理解
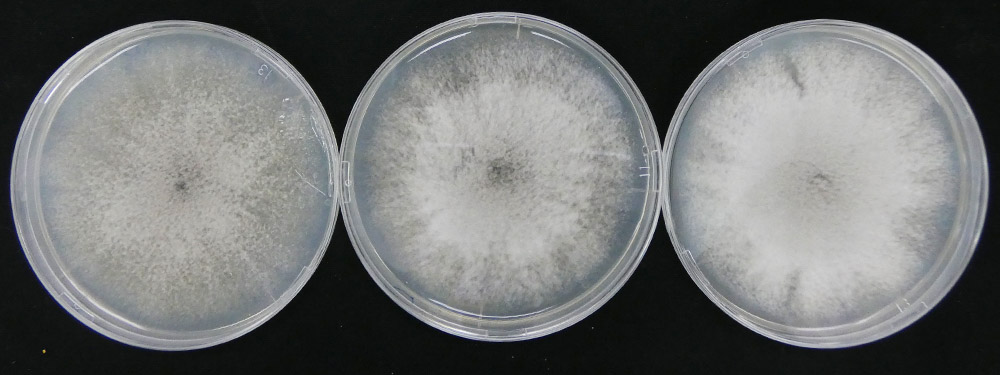
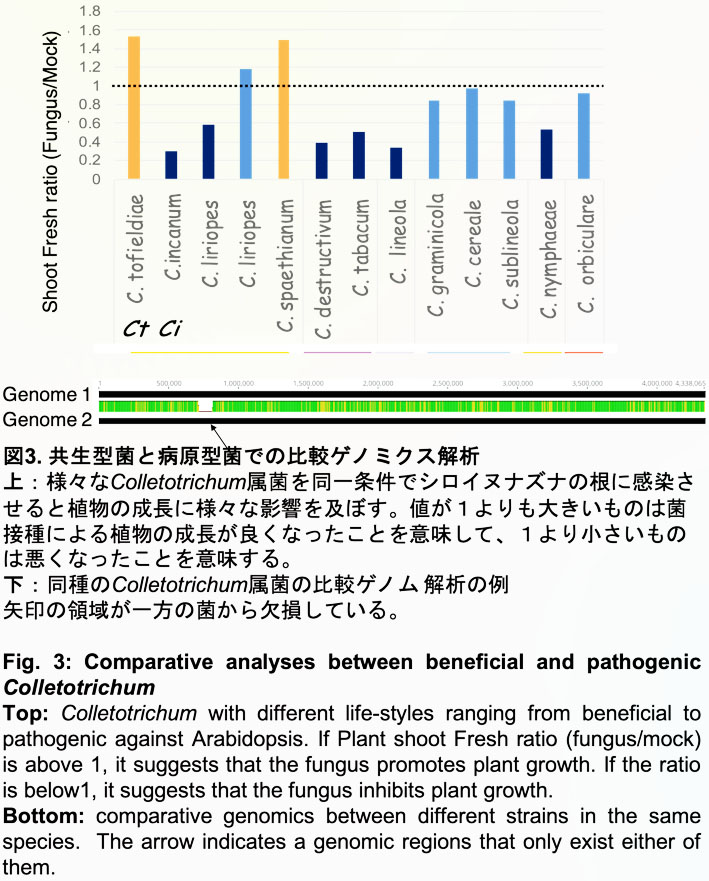
1)で紹介したCtは貧栄養環境下で植物生長を促す共生菌ですが、近縁種には同一植物に対して炭疽病を引き起こす病原菌が存在しています(C. incanum, 図2)。全ゲノム情報を比較すると両者は大部分の遺伝子を共有していることも明らかになっています(Hacquard et al., Nat Commun 2016; Hiruma, 2018 Jpn.J.Phytopathol, Hiruma, Evolutionary Biology2020 )。この事実は、共生菌として振舞う菌も病原性を発揮する潜在性はゲノム上に有しており、共生菌の安定的な活用のためにはその植物生長促進基盤を明らかにすることに加えて、隠れた病原性を抑える方策を同時に提案することの重要性を強調しています。私たちは、Ctが属するColletotrichum属菌には共生から病原へと多彩な感染戦略を示す菌株が存在する他にない利点を活かした比較ゲノミクス(比較ゲノム ・トランスクリプトーム解析など、図3)を駆使して、共生性や病原性を分ける鍵因子を植物・菌双方から同定しようと研究を開始しています。 (Hiruma et al., 2022 bioRxiv doi: https://doi.org/10.1101/2022.07.07.499222) 。同定した鍵因子の制御基盤を理解しその因子をターゲットとすることにより、病原菌そのものではなくその病原性の基になる分子の抑制方法を開発することが可能となると期待しています。これにより、微生物の種類に問わず抑制してしまう従来の多くの農薬とは異なり、その地に受け継がれてきた微生物の潜在性を活かしつつ病原菌化は防ぐ道が開けると期待しています。さらに、応用面だけではなく、「共生性と病原性の境は?」という微生物学にも根源的な質問に対する興味深い答えを提唱できると考えています。
2) Commonalities and differences in microbial pathogenic and mutualistic life-styles in planta
In nature, plants interact with a diverse range of microbes, from pathogens that impede plant growth to mutualists that enhance plant fitness. However, it remains largely unknown which molecular factors are involved in discriminating between pathogens and mutualists. By conducting in-depth comparative analyses of closely related pathogenic and mutualistic microbes, we aim to identify plant and/or microbe molecular factors that determine the microbial lifestyle transition as either a pathogen or a mutualist in plants. Revealing the mode of action of the factors responsible for lifestyle transition will aid in understanding how to best utilize beneficial microbes while suppressing potential pathogenesis. Currently, we are focused on performing functional comparative analyses between pathogenic and mutualistic Colletotrichum species in A. thaliana (Figure 3). One example of such analyses is the comparison between beneficial and pathogenic Ct strains (Hiruma et al., 2022 bioRxiv, doi: https://doi.org/10.1101/2022.07.07.499222)."
3) 糸状菌および細菌からなる人工共生微生物群による協調的な植物生長促進基盤の理解
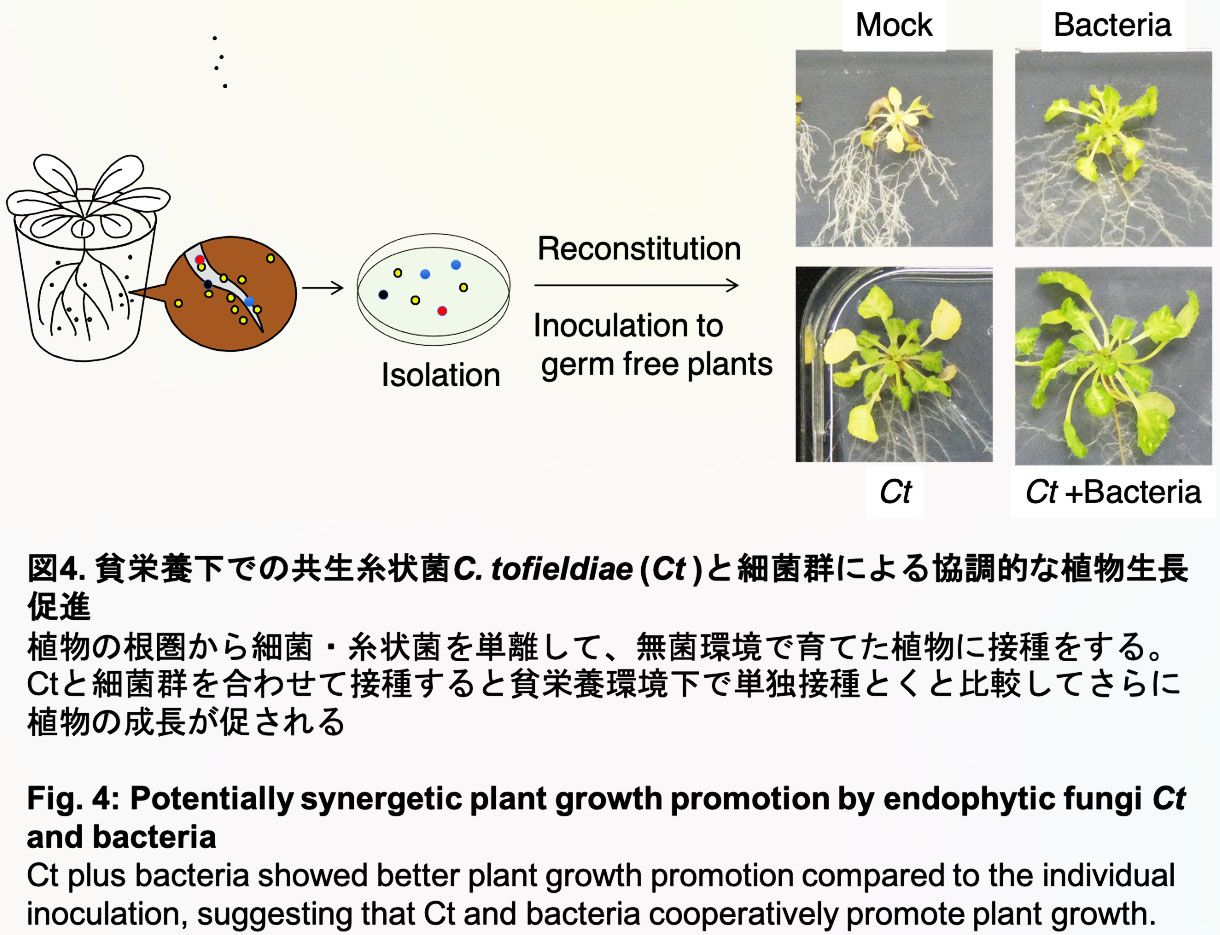
上で述べた通り、植物の表面および内部には無数の微生物が棲息しており、植物は様々な微生物との共生関係を通じてストレス環境への適応能力を発揮しています (Hiruma et al., Cell 2016)。これは言い換えると、植物は自身に環境適応能力を付与する微生物群をいわば拡張された自己として取り込んだ高次共生体「植物微生物共生体」を形成しているとも言えます。これまでの研究では、植物と微生物の1対1相互作用の分子機序の解明に重きが置かれ、多元的な相互作用から成り立つ植物微生物共生体の実態やその成立・維持機構に関しては明らかではありません。私たちは共生菌Ctが野外圃場環境下でもアブラナ科植物の生長を促すこと、および、その植物生長促進効果の背景では、Ctが特定の土壌・根圏細菌群を誘致することを見出しました。次に、実際にCtが感染した根から細菌群を(一部)単離し、実験室環境下でCt-細菌集団を再構成しました。その結果、Ct-細菌群は貧栄養環境下で協調的に植物生長を促すことを見出しました(図4)。つまり、Ctは貧栄養環境下で自身の力によって植物生長を促すだけでなく、植物生長に寄与する細菌群を誘引することにより協調的に植物生長を促すことが考えられました。どのようにCtが有用細菌群を誘致して協調的な共生効果を発揮するのか、また、宿主である植物がどのようにこれらの微生物群を制御しているのかに特に興味を持って研究を進めています。本系はこれまでの1対1相互作用とは異なり、2者以上の変数を扱う複雑性科学の特徴も有した系になっていることから、植物科学や微生物科学といった分野の研究者に加えて、数理生物学など数学的・物理学的視点を持った幅広い専門性を持つ研究者との共同研究も進めていく必要性がある挑戦的かつ裾の広いテーマだと考えています。
3) Molecular mechanisms by which beneficial fungi and bacteria promote plant growth as consortium under nutrient limiting conditions (Plant-Microbe Holobiont).
We seek to discern the temporal and mechanistic aspects underlying the emergence of a cohesive and functional microbial community that exhibits enhanced beneficial effects on the host plant. We have obtained preliminary data that indicates the co-inoculation of Ct with various bacterial strains confers superior growth performance to the host plant, compared to individual inoculations, particularly under low nutrient conditions (Figure 4). We aim to unravel the intricate interplay and functional dynamics of this microbial consortium towards facilitating plant growth, by investigating the molecular mechanisms underlying its formation, structure, and function.
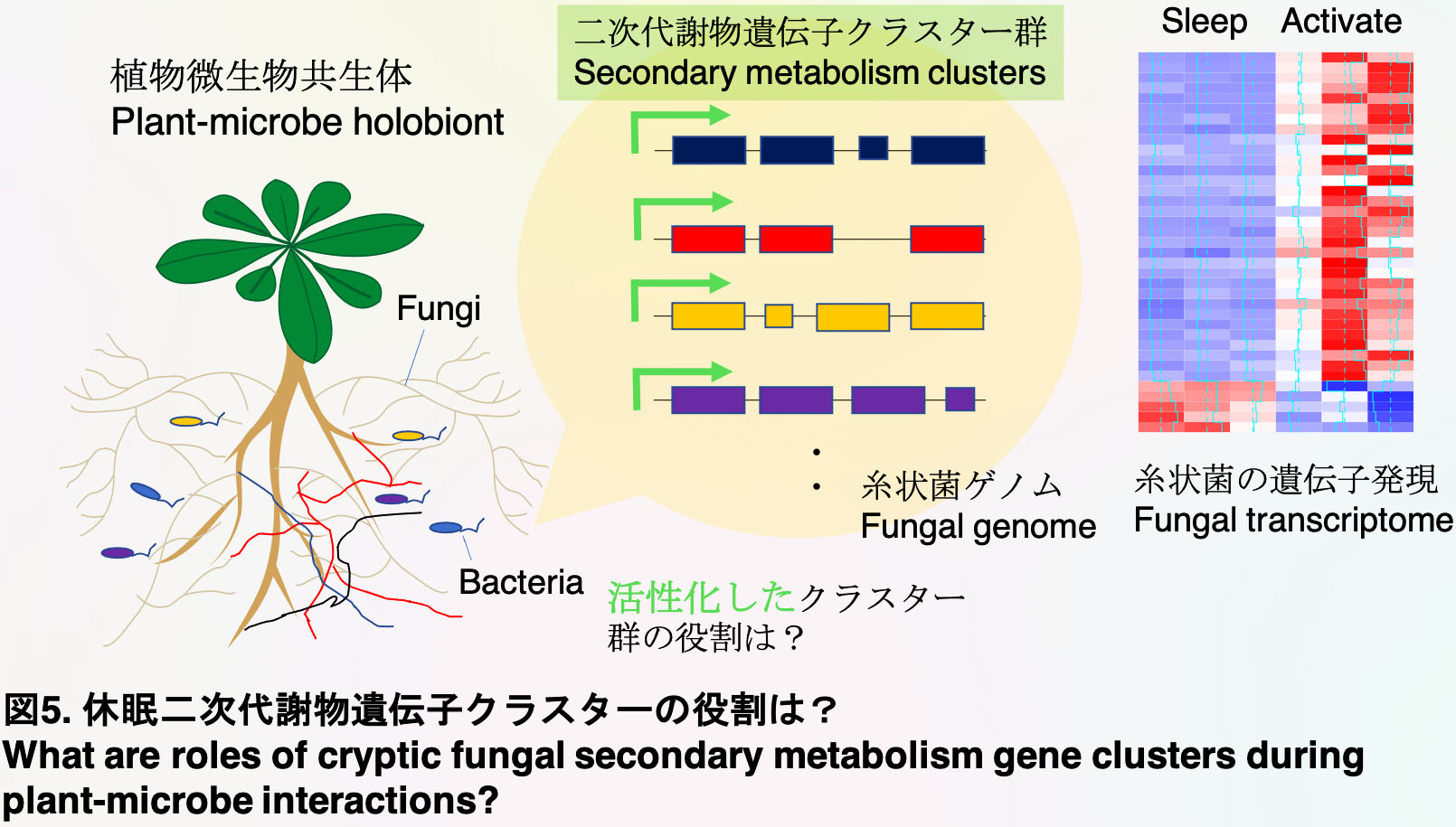
4) 糸状菌が持つ休眠二次代謝物クラスター群の役割の理解
生物が産生する化合物は有用な生理活性を持つものが多いことが知られています。これらの多くは二次代謝物と呼ばれる化合物群で、農薬・医薬品や香料などとして活用されています。中でも、植物と相互作用する糸状菌が多種多様な二次代謝物を生成する潜在性を有することがゲノム情報の蓄積やその解析手段の発達により明らかになっています。糸状菌のゲノムにおいて、一つの二次代謝物合成に必要な酵素遺伝子群やその制御転写因子は通常同一領域でクラスター化されており、それらの合成クラスターの数や構成は近縁種間でも大きく異なっています。このクラスターの数・構成の多様性は、植物や他の微生物との進化的軍拡競争の最中に、生態的地位を共有する微生物との間でのクラスターの断続的な水平移行により獲得され、糸状菌の環境への適応に重要な役割を担っていることが想定されています。しかしながら、既存の制御実験環境では、糸状菌ゲノム上に存在する二次代謝物遺伝子クラスター群の大半はそのクラスター内の遺伝子群の発現が誘導されない休眠(不活性化)状態であり、それ故、糸状菌二次代謝物遺伝子群クラスターの役割(機能)やその化合物としての有用性に関してこれまで得られた知見は極めて限られています。
私たちは、従来休眠状態だった二次代謝物クラスター群が土壌・根圏の他の微生物群と協調的もしくは競合的な相互作用する(植物微生物共生体を形成する)際に活性化することを見出しています(投稿中、Pathompitaknukul, Hiruma et al., bioRxiv 2020、未発表)。これらの発見は、単独の感染戦略を示す1種類のモデル微生物を実験室環境で解析した場合は休眠状態であった二次代謝物クラスター群は、植物環境で他の微生物群と相互作用する際に初めて活性化することを意味します。つまり、糸状菌の休眠二次代謝物遺伝子クラスター群の活性化およびその有効活用は、植物微生物共生体という、微生物の本来の生育環境を分子遺伝学的解析が可能な形で再構築することで、可能となることが期待できます(図5)。私たちは、活性した休眠二次代謝物クラスター群の植物や他の微生物との相互作用する際の役割を明らかにするとともに、クラスターから合成される二次代謝物の同定を目指したいと考えています。
4) Potential roles of fungal secondary metabolism gene clusters during plant-microbe interactions
Microbes have evolved various secondary metabolites. Fungal secondary metabolite biosynthetic genes, as well as their regulatory genes, are often clustered in genetic loci. However, these secondary metabolism genes are often not expressed even during host interactions in conventional laboratory setting. These limitations did not enable us to reveal the roles of secondary metabolism clusters in plant-infecting fungi.
We find that some of the secondary metabolism gene clusters are activated when a microbe interacts with other microbes in plant roots (Unpublished, Pathompitaknukul, Hiruma et al., bioRxiv 2020). These results suggest that these secondary metabolism gene clusters have roles during interactions with other microbes in plant environment. We are trying to reconstitute an environment whether a fungus activates these cryptic secondary metabolism clusters and to understand the potential roles during plant-microbe-microbe interactions (Figure 5).