研究内容
細胞機能工学部門は、生物生産工学研究センターの2期がスタートした2003年4月に開設されました。この私たちの研究室では、生物がもつ様々な有用な能力に着目し、背景にある生命活動に普遍的な原理をタンパク質や遺伝子などの分子レベルで解明することを目指しています。さらに、それらの成果を利用して有用な機能を人為的に更に強化し、より有用な酵素や化合物を創製する応用的な研究も行っています。そのため、アミノ酸や抗生物質のような生理活性低分子化合物を扱う天然物化学から、遺伝子の発現制御解析を行う分子生物学、さらにはタンパク質や酵素については、機能解析からタンパク質工学、X線結晶構造解析まで、最先端のテクノロジーを用いて多種多様なレベルで研究を行っています。以下に主な研究テーマを紹介します。
微生物におけるアミノ酸生合成経路の解明とその進化に関する研究
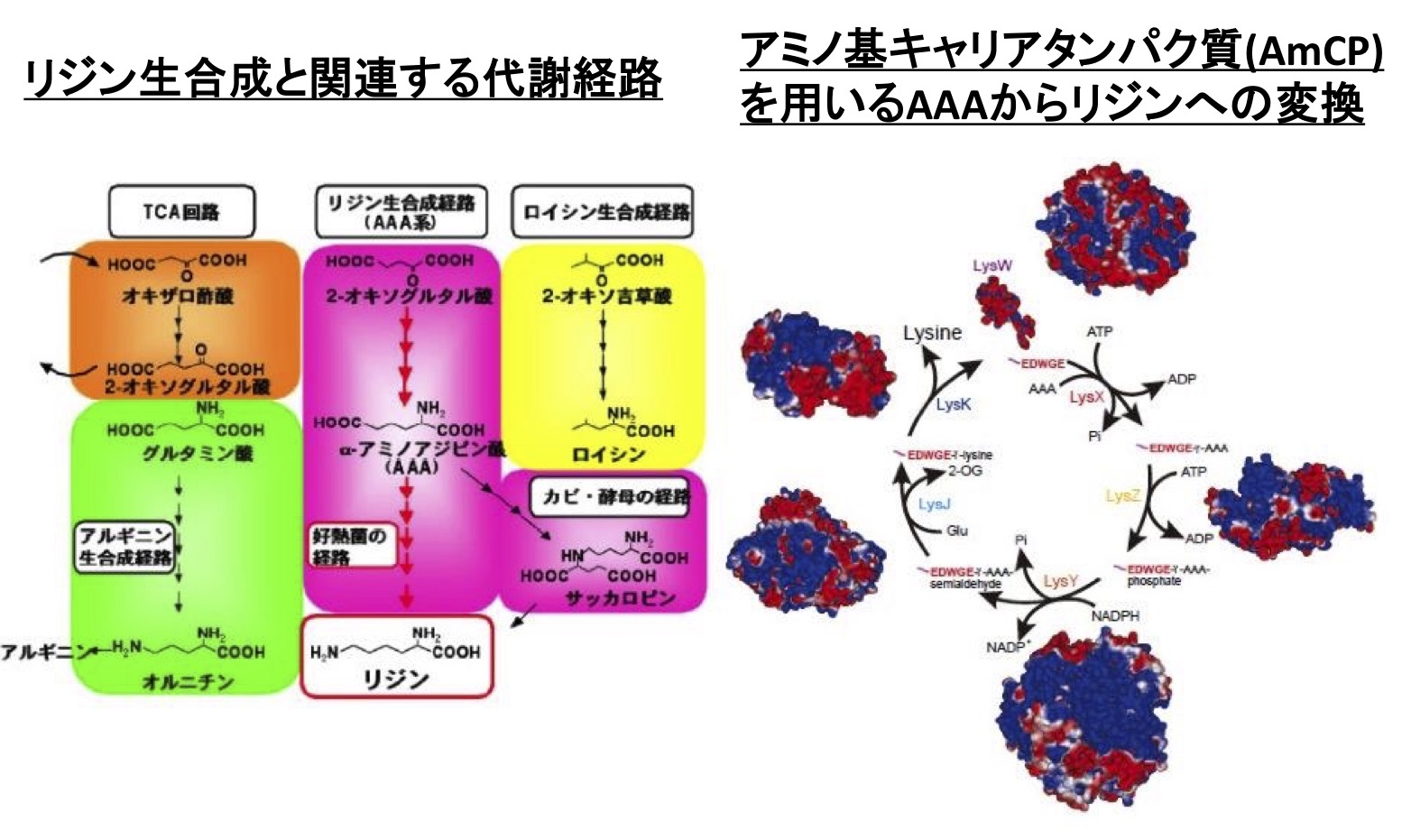
リジンは酵母やカビではα-アミノアジピン酸を経由するAAA経路によって合成され、バクテリアや植物ではジアミノピメリン酸を経由するDAP経路によって合成されます。しかし、私たちは好熱菌Thermus thermophilusのリジン生合成がバクテリアとして初めてAAA経路によってリジンを合成することを発見しました(図1)。また、私たちは生命の共通祖先に近縁であると考えられている古細菌も同様のリジン生合成経路を持っていることも明らかにし、実際にこの生合成システムがリジンだけでなくアルギニン生合成にも関与していることがわかってきました。好熱菌が持つこの経路を構成する酵素は通常の酵素に比べ基質特異性が寛容であるという性質を持っています。酵素の分子進化仮説の一つとして「パッチワーク仮説」がありますが、これは現存する厳密な基質特異性を有する酵素のレパートリーはもともと一つの基質特異性の寛容な祖先型酵素が、様々な物質変換系に関わり、多様な代謝系を構成したというものです。この仮説によれば、進化の過程で各酵素遺伝子が重複・機能分化し、多様化することにより、現在の代謝系酵素群が出来上がったと考えることが出来ます。このことから好熱菌のリジン生合成酵素は祖先型酵素の性質の名残を持っているものと考えられました。私たちはこのような酵素の機能・構造解析を進めることにより、酵素の基質認識機構を解明すると同時に、各酵素、さらにはそれらの酵素系が関わる代謝自体の分子進化メカニズムについて明らかにすることを目指しています。
アミノ基キャリアタンパク質(AmCP)を介して生合成される多様な天然化合物の探索研究
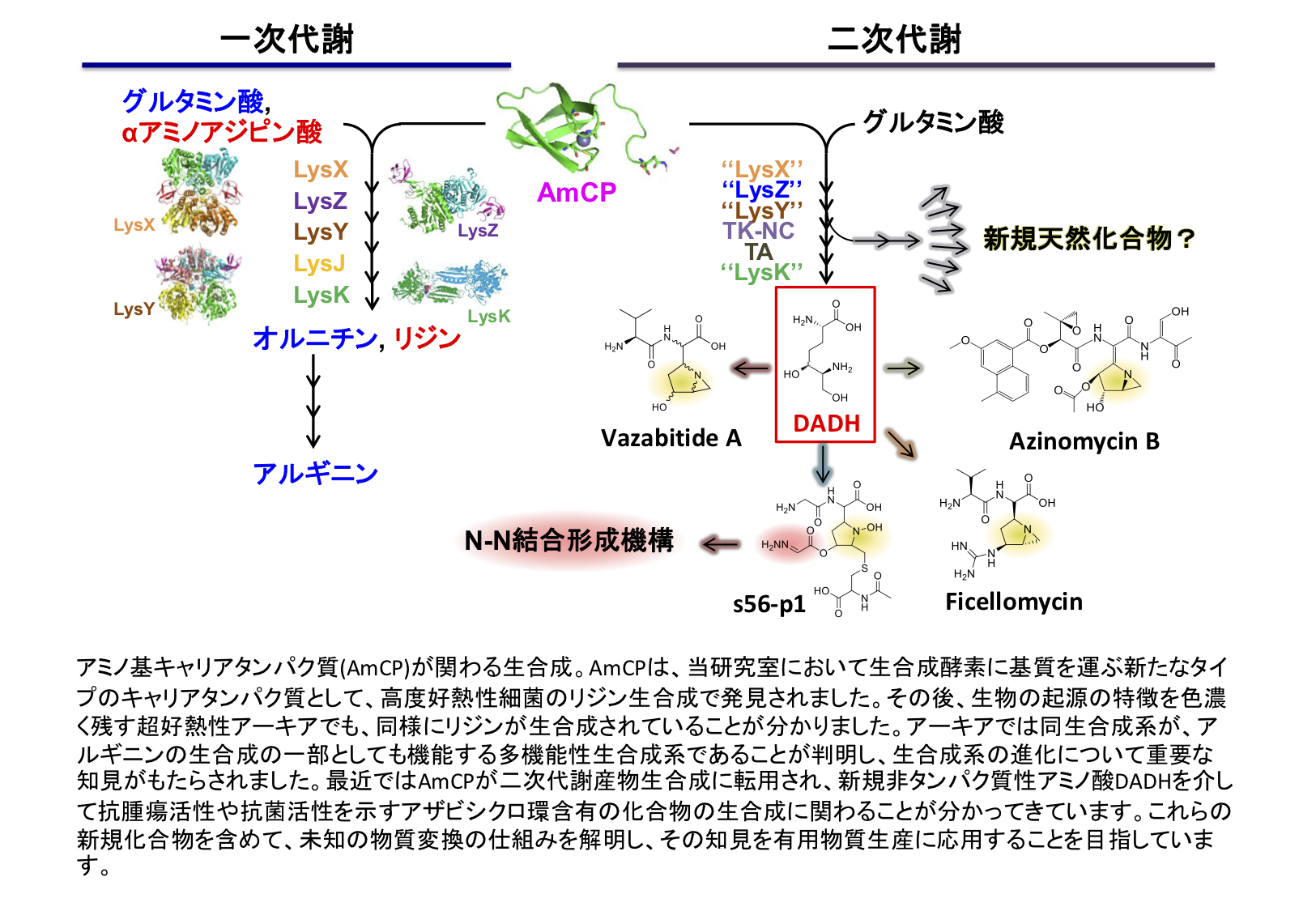
私たちはリジン生合成経路の研究を行う過程で、その後半部分(alpha-アミノアジピン酸からリジンへの変換)がキャリアタンパク質を用いて不安定な生合成中間体を保護しながら進行することを発見しました(図1)。これはアミノ酸生合成に関与するキャリアタンパク質の初めての発見であるだけでなく、高温条件における効率的なアミノ酸発酵生産の基盤となるものとして期待されます。最近、私たちは類似のシステムが放線菌の二次代謝物質の生産にも利用され、新奇な非タンパク質性アミノ酸の生産に関わっていることを明らかにしました(図2)。データベース解析から他の多数の生物にも類似のシステムが存在することが示唆されており、それらの生合成系を解明し、新規有用物質の生産を目指しています。これらの研究は、科研費補助金(基盤研究(S))「アミノ基修飾型キャリアタンパク質を介した物質変換機構の解明と応用展開」として推進しています。
リジンアシル化修飾を介した細菌のタンパク質機能調節と栄養応答に関する研究
アセチル化に代表されるタンパク質(リジン)アシル化修飾は、生物に広く存在する翻訳後修飾です。アシル化修飾はアシルCoAやアシルリン酸など代謝中間体を利用して酵素・非酵素的に起こることから、細胞の代謝・栄養状態と密接に関連します(図3)。私たちは細菌のアシル化修飾(主にアセチル化とスクシニル化)が栄養条件や培養フェーズに応じてダイナミックに変化することを見出し、代謝酵素や翻訳関連因子に起こるアシル化修飾がタンパク質機能に与えるインパクトを明らかにしてきました。グルタミン酸発酵で知られるCorynebacterium glutamicumやモデル細菌である枯草菌(Bacillus subtilis)を対象に、栄養環境に応じて変化するアシル化修飾が細胞の応答や機能にどのようなインパクトを与えるかを明らかにする研究を展開しています。また、代謝酵素の可逆的凝集体形成(メタボロン)とアシル化修飾の関連についても研究を進めています。

タンパク質相互作用を介した酵素機能制御機構に関する研究
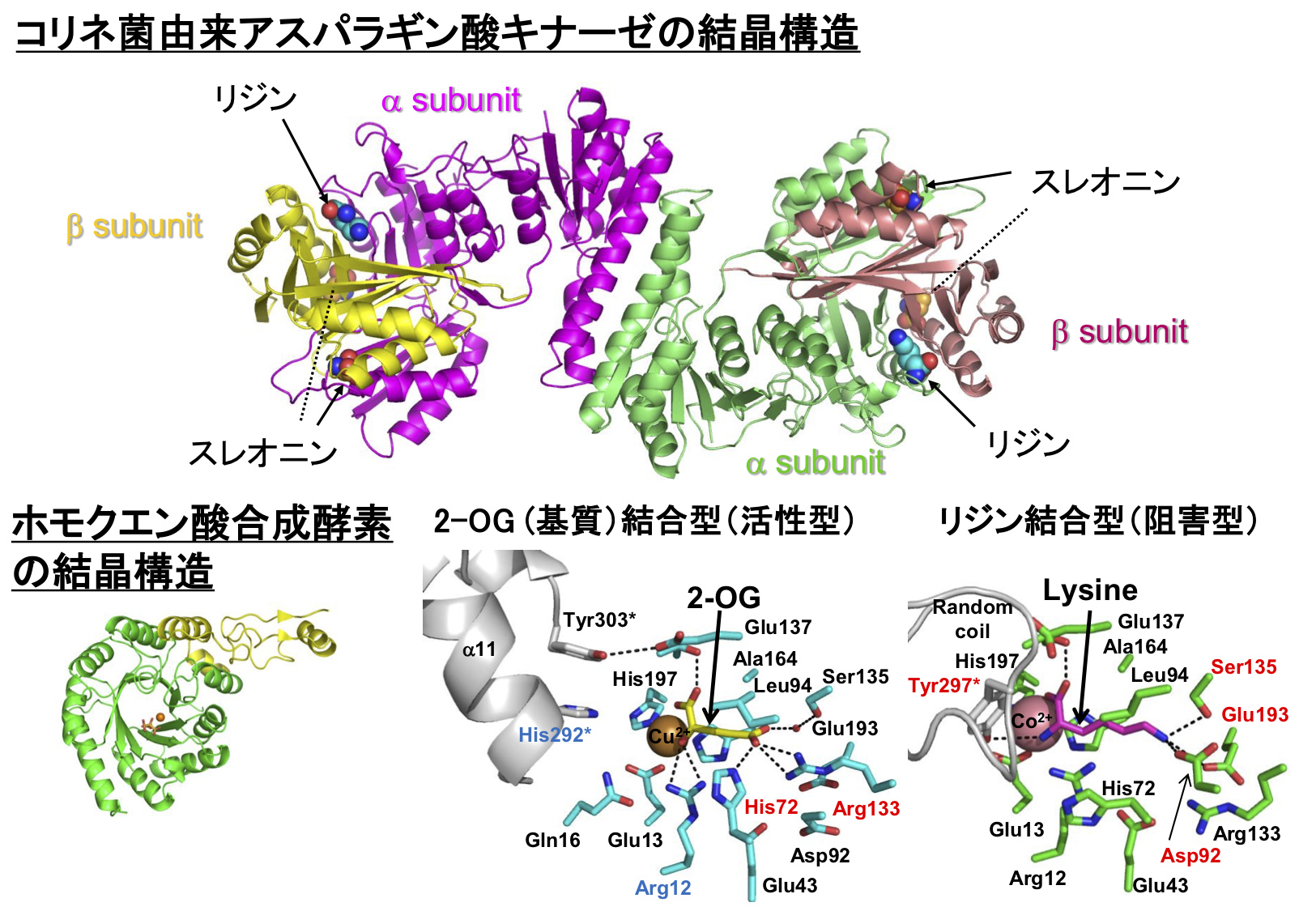
アミノ酸の生合成や代謝に関わる酵素は、生合成の最終産物によるフィードバック調節を受けることが古くから知られていますが、他にも細胞の環境や栄養状態を感知し、様々な調節を受けることがわかりつつあります。私たちはリジン発酵の鍵酵素であるコリネ菌のアスパラギン酸キナーゼの結晶構造を決定し、リジン高生産の分子機構を明らかにしてきました(図4)。また、好熱菌のリジン生合成の初発酵素であるホモクエン酸合成酵素の結晶構造を決定し、そのユニークなフィードバック阻害機構を明らかにしました。さらに、酵素の立体構造情報を利用しその触媒機構や調節機構に関する詳細な解析を行うことにより、高活性化・高機能酵素への改変を目指した研究も行っています。また、我々は代謝酵素と他のタンパク質との相互作用に着目し、新たな代謝酵素調節機構の探索・解析を進めています。このような調節機構を明らかにすることによって、細胞の代謝フラックスをコントロールすることが可能になると考えています。こうして得られた知見をもとに新たな物質生産系を構築することも視野に入れて研究を行っています。