ウイルス研究
植物ウイルスの検出・同定と分類体系の確立
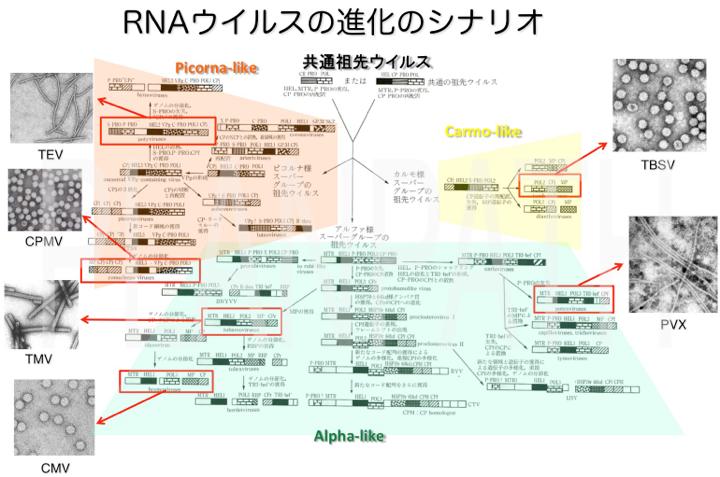
ウイルスは自身の細胞を持たず、宿主細胞内でのみゲノムを増殖させることができます。従ってウイルスの上位の分類はゲノム核酸の性状によって決められています。すなわち、ゲノム核酸がDNAであるかRNAであるか、さらに1本鎖であるか2本鎖であるか、直接翻訳の鋳型となる+(プラス)鎖となるか相補鎖が鋳型となる-(マイナス)鎖となるか、さらに単一のゲノム核酸からなるか複数の分節したゲノムからなるか、などの基準で分類されます。なかでも植物ウイルスの多くは1本鎖RNAをゲノムに持ちます。我々は1990年代から、多くの農業生産上重要な植物RNAウイルスを同定し、そのゲノム塩基配列を決定してきました。(Hashimoto et al., 2008, 2009; Lu et al., 1998a, 1998b; Kagiwada et al., 2002; Komatsu et al., 2005, 2007, 2008; Nakabayashi et al., 2002; Namba et al., 1991a, 1991b, 1998; Ohira et al., 1994a, 1994b)。こうした研究は、未整備であった植物ウイルスの分類体系の確立に大きく貢献し、これによりRNAウイルスの進化のシナリオが明らかになってきました(Candresse et al., 1995; Komatsu et al., 2008; Martelli et al., 1994; Namba, 1995; Yamaji et al., 2001a, 2001b; 難波, 1996; 難波・鍵和田, 2007)。
2010年代になり、グローバル化に伴う海外からの植物の輸入の増大によって、日本では本来発生していなかったウイルスの報告が多くなっています。我々は、plum pox virus(PPV;ウメ輪紋ウイルス)をはじめとして、こうしたパンデミック(汎発流行)性ウイルスも日本に先駆け報告・全ゲノム配列を決定しており、その侵入経路などについて多くの知見を得ています(Ishikawa et al., 2012a, 2012b; Maejima et al., 2010, 2011a, 2011b; Okano et al., 2010; Shiraishi et al., 2011, 2013; 前島ら, 2009; 前島・難波, 2010a, 2010b)。
なかでも、我々が主な研究対象としているTobamovirus 属ウイルス、Potexvirus 属ウイルスおよびComovirus 属ウイルスは、いずれも古くから研究されてきたウイルスです。いずれも(+)1本鎖RNAをゲノムとするものの、互いにゲノム構造や遺伝子発現機構などの点で大きく異なる特徴を持っています。我々は複数のウイルス属を研究対象とすることにより、多様な植物ウイルスに共通した感染戦略・病原性発現機構を明らかにすることを目指しています。
ウイルスの感染戦略
植物ウイルスは植物体表面についた傷や昆虫などの媒介生物により植物細胞に侵入します。するとウイルスは直ちに植物細胞の翻訳機構を利用してウイルスタンパク質を翻訳し、ウイルスゲノムの『複製』を開始します。初期感染細胞で増殖したウイルスは、細胞間移行と呼ばれるステップに移りプラズモデスマータを介して隣の細胞に移行します。そして植物ウイルスは複製と細胞間移行を繰り返すことで周囲の細胞へと拡がったのちに、維管束系へと侵入し植物体全身へと拡大するのです(『長距離移行』)。
植物ウイルスは、『複製』・『細胞間移行』・『長距離移行』のすべてのステップで、自身のゲノムにコードされる限られた数の遺伝子を駆使し、植物細胞の代謝系に依存しながら植物タンパク質を巧妙に利用していると考えられています。

各感染ステップを分子レベルで詳細に明らかにすることにより、植物ウイルスに対する新たな防除戦略を構築することが求められています。我々は、植物ウイルスの感染を再現し、ゲノムの改変を容易にする系を複数のウイルスで構築し(Komatsu et al., 2013; Ohira et al., 1995, Ozeki et al., 2006)、それを用いて、ウイルスの感染ステップのなかでも特に、『複製』および『細胞間移行』について解析を行ってきました。
複製に関与する宿主因子
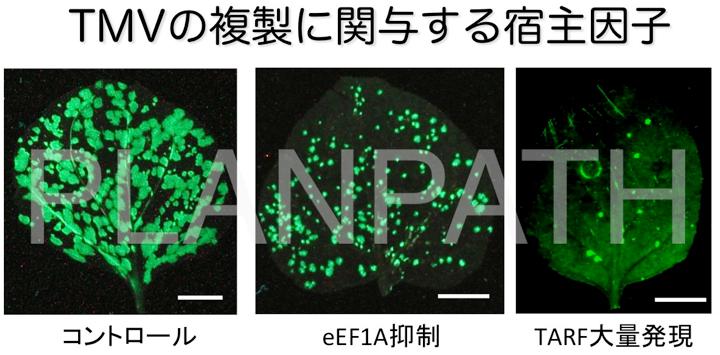
植物ウイルスのモデルとして最も良く知られているのが、tobacco mosaic virus(TMV)です。我々はTMVとその宿主植物であるタバコをモデル系としてウイルスの複製に関わる宿主因子のスクリーニングを行いました。その結果、植物の翻訳機構に関わるeEF1AがTMVの複製酵素とゲノムRNAと結合することを明らかにしました(Yamaji et al., 2006)。さらに、eEF1Aの具体的な機能を明らかにする目的で、ウイルスベクターを用いて遺伝子の機能を抑制するVIGS(virus-induced gene silencing)法を試みました。eEF1Aを抑制したところ、TMVの増殖量が減少しウイルスの拡がりも顕著に抑制されることを明らかにしました。以上の結果からeEF1AはTMVの複製酵素ならびにゲノムRNAに結合することにより、ウイルス感染に密接に関わる因子であることを明らかにしました(Yamaji et al., 2010a)。また、同じくTMVの複製酵素と結合する宿主因子でありながら、TMVの感染を抑制する働きをもつタンパク質が植物に存在することも明らかにしました(Yamaji et al., 2010b)。ウイルスは、こうした自分の感染に重要なタンパク質、感染を阻害するタンパク質と密接に関わりながら、感染を成立させていると考えられます。
細胞間移行に関わるウイルスタンパク質
植物ウイルスは細胞間移行に必須な移行タンパク質を持っており、これまでに移行タンパク質の機能は詳細に明らかにされてきました。一方で、移行タンパク質に加えてウイルス粒子を形成する外被タンパク質(coat protein; CP)も複数のウイルス属では細胞間移行にも関わっていることが知られています。我々が解析に用いたPotexvirus 属では、CPが細胞間移行に関わることが知られています。はじめにPotexvirus 属ウイルスの細胞間移行を可視化するため、蛍光タンパク質GFPを用いたトランス相補実験系を確立しました。
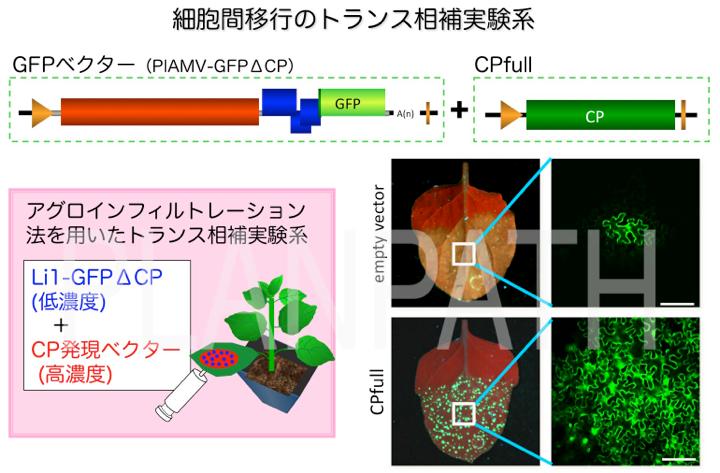
この実験系を用いることによりCPに様々な変異を導入してウイルスの細胞間移行を調べたところ、CPのアミノ末端領域のわずか5アミノ酸が細胞間移行に重 要であることがわかりました。さらにアラニンスキャニング変異導入法により、アミノ末端領域の3番目のロイシン残基が細胞間移行に重要であることを明らか にしました(Ozeki, et al., 2009)。
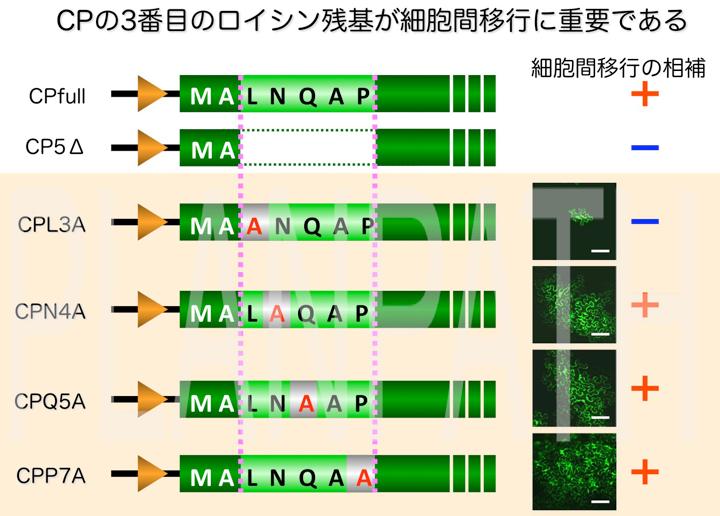
Potexvirus 属ウイルスのCPアミノ末端領域はウイルス粒子の表面に露出することが知られています。したがって、3番目のロイシン残基を含む領域は移行タンパク質などのウイルス因子や植物タンパク質と相互作用するのではないかと考え、現在さらに研究を行っているところです。
また、我々は同様の細胞間移行のトランス相補実験系を用いて、ダニ媒介性のマイナス鎖RNAウイルスであるイチジクモザイクウイルス(fig mosaic virus; FMV)のゲノムから、これまでFMVを含むウイルス属で存在が明らかになっていなかった移行タンパク質(movement protein; MP)を世界で初めて同定しました(Ishikawa et al., 2013)。
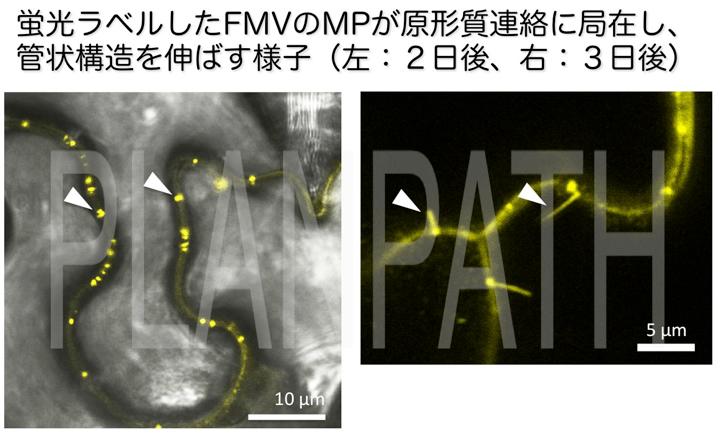
移行タンパク質もまた、複製酵素と同様に多くの宿主因子との相互作用でその機能を発揮しることが明らかになってきました(Shimizu et al., 2009; Yoshii et al., 2008)。我々は、植物ウイルスの感染の重要なフェーズである細胞間移行の機構をより解明することで、ウイルスの抑制戦略の構築に向けた基礎的な知見を積み上げていきたいと考えています。
植物のウイルス耐性戦略ーRNAサイレンシングー
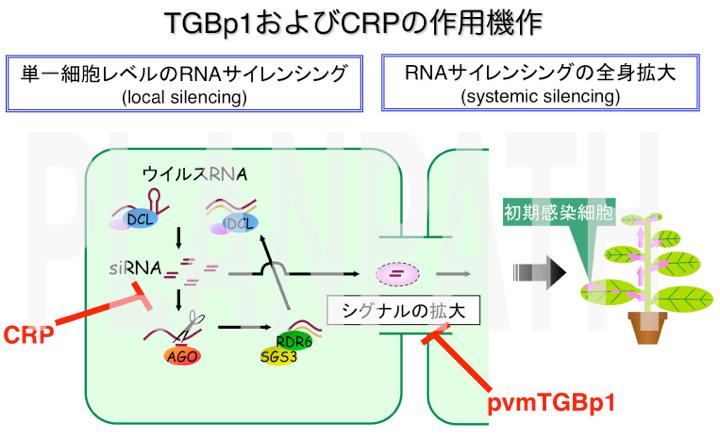
RNAサイレンシングは広く真核生物に保存された、small RNAと呼ばれる二十数塩基の小さいRNA分子を介した遺伝子発現制御機構です。RNAサイレンシングでは、まず二本鎖RNA(double-stranded RNA; dsRNA)からsmall RNAが切り出されます。次にsmall RNAと相同な配列を持ったmRNAの切断分解あるいはDNA配列のメチル化などが誘導されることによって遺伝子発現が抑制されることが、近年の研究からわかってきました。RNAサイレンシングは植物においては器官の形態形成や環境ストレス応答などあらゆる生育過程に関わっています。また、植物ウイルスの多くはRNAをゲノムに持つことから、植物ではウイルス防御機構としても機能します。植物細胞内でウイルスの複製中間体として形成されるdsRNA等が認識されてsmall RNAが生成され、ウイルスに対するRNAサイレンシングが誘導されると考えられています。
一方で、ウイルスは対抗手段として宿主のRNAサイレンシングを抑制するタンパク質(サプレッサー)を持っています。例えば、tomato bushy stunt virusが持つp19はsmall RNAに直接結合することによりRNAサイレンシングを阻止する機能を持っています。そのほかにも、これまでに様々な植物ウイルスから多種多様なサプレッサーが発見されていますが、RNAサイレンシングを阻害するメカニズムはサプレッサーごとに異なることがわかっており、p19のように詳細なメカニズムが明らかにされているものは限られています。
植物ウイルスはサプレッサーによってRNAサイレンシングを抑制し、感染を成立させるものと考えられています。しかし、我々がジャガイモXウイルス(potato virus X; PVX)を含む複数のPotexvirus 属ウイルスを比較解析した結果、ウイルス感染時のRNAサイレンシング抑制能はウイルス種によって異なることがわかりました。さらに、サプレッサーであるTGBp1の活性を解析したところ、ウイルス間でTGBp1のサプレッサー活性が大きく異なっており、これがウイルス感染時のRNAサイレンシング抑制能の違いの原因であることが明らかになりました(Senshu et al., 2009)。
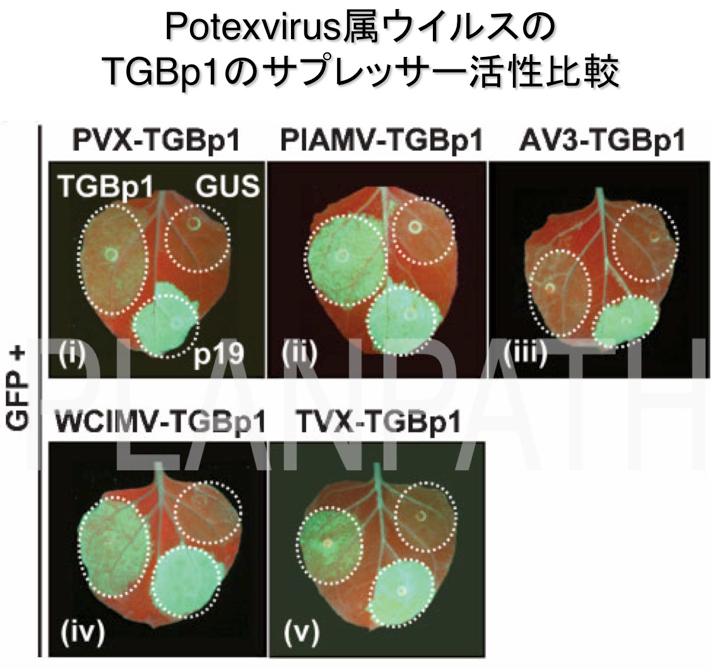
解析に用いたウイルスはそれぞれ固有の原宿主を持つことから、各ウイルスはそれぞれの原宿主においてRNAサイレンシングに対する適応進化を遂げており、その結果、このようなサプレッサー活性の違いが生じたのかもしれません。
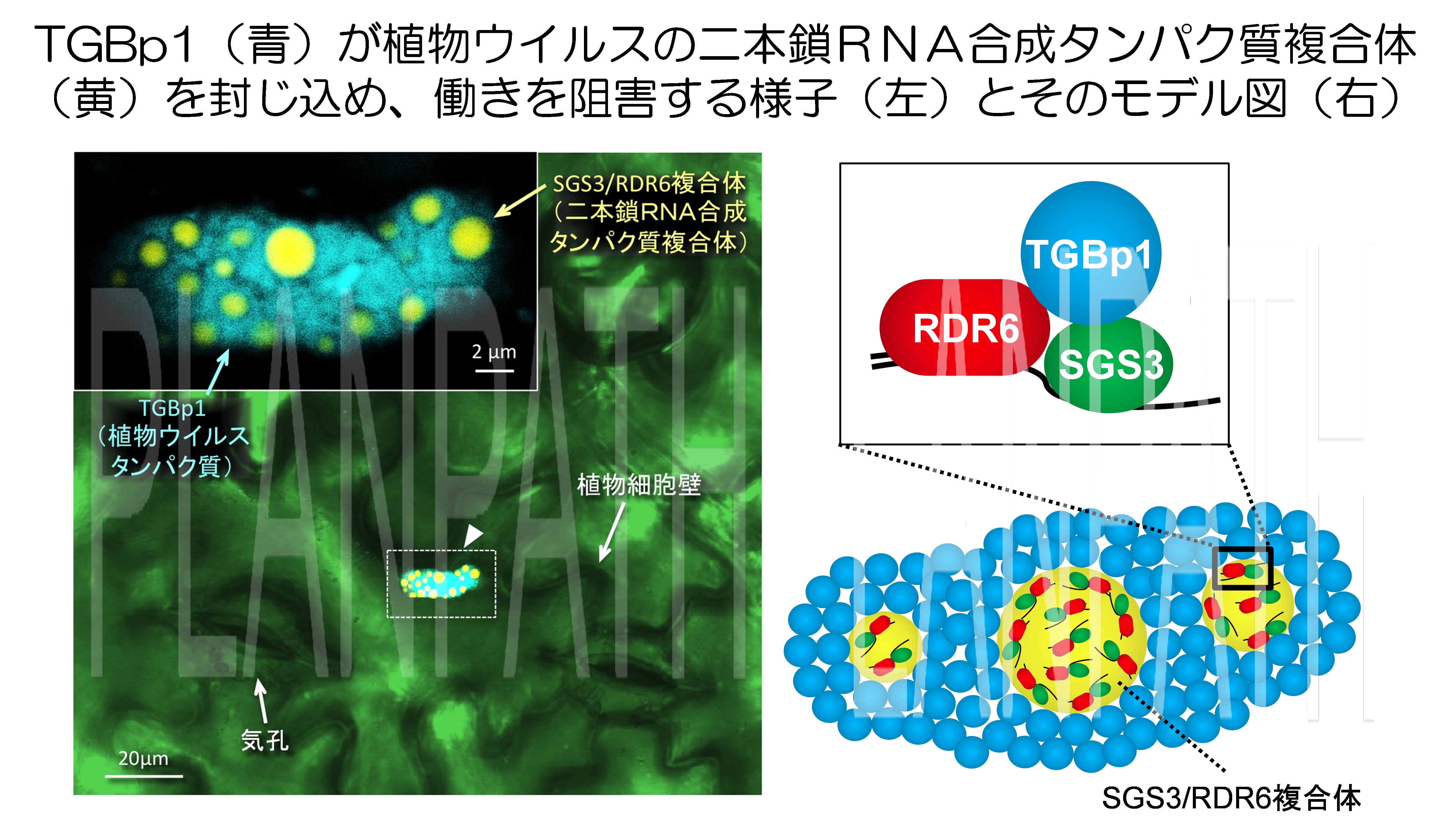
RNAサイレンシングはウイルス防御機構の重要な一翼をになっており、とくに二本鎖RNAを合成してRNAサイレンシングをより強化する過程が発見されています。この過程は、ウイルス侵入のシグナルを植物体全身に伝えるうえでも重要な役割を果たしています。我々は、Potexvirus 属ウイルスであるplantago asiatica mosaic virus (PlAMV) のサプレッサータンパク質(TGBp1)が、植物のRNAサイレンシング増幅過程を阻害すること、ならびにそのメカニズムを初めて明らかにしました(Okano et al., 2014 Plant Cell)。
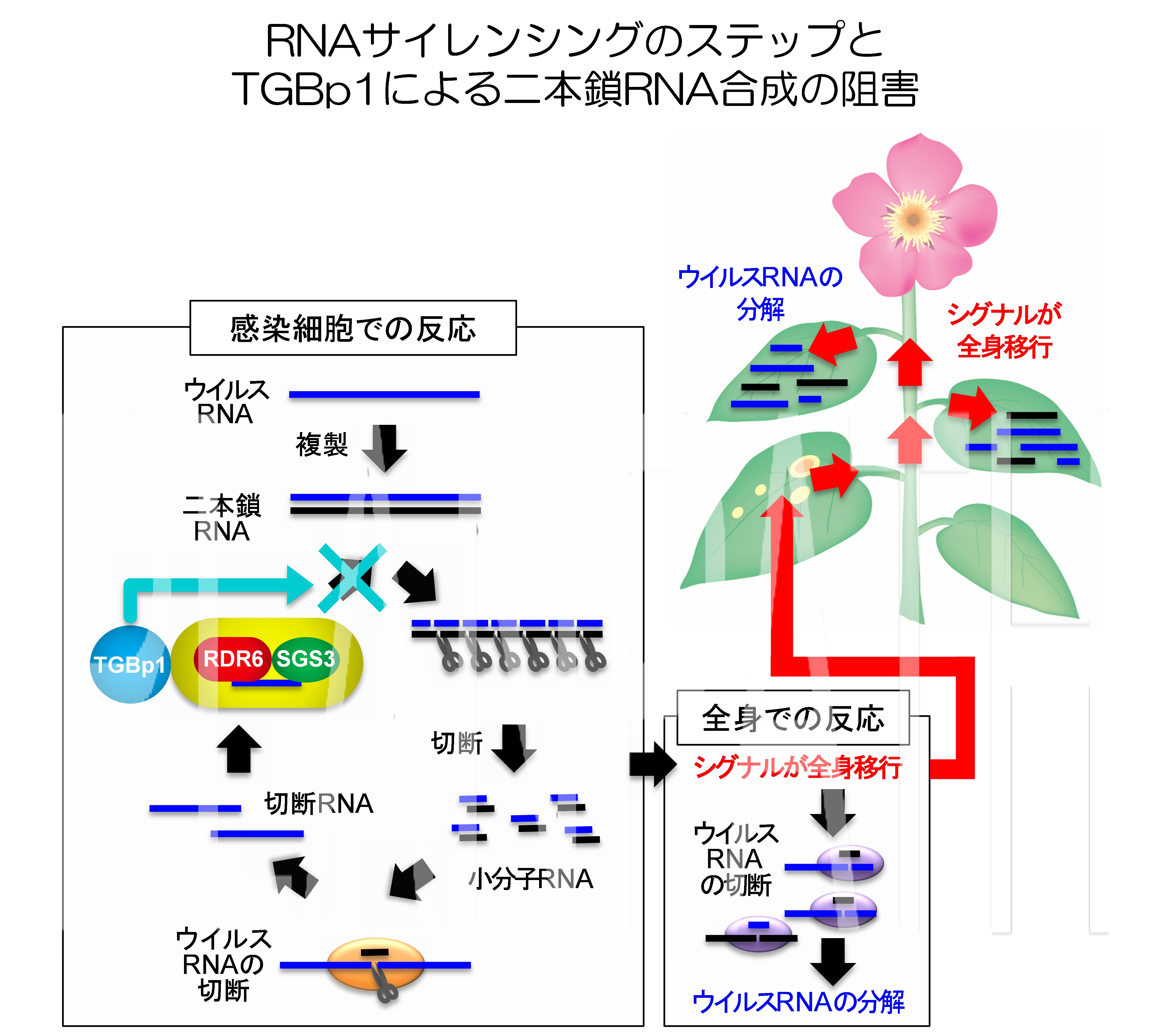
TGBp1は、二本鎖RNAを合成する植物側のタンパク質の複合体 (SGS3/RDR6 body) に結合し、それらを細胞質中で取り囲み凝集させることを視覚的にも突き止めることに成功しました。PlAMVはサプレッサーTGBp1を駆使して、自らを異物と認識し、防御応答システムを起動する植物のRNAサイレンシング機構の増幅過程を抑制し、ウイルスの全身感染を可能にしているのです。
さらに我々は、今までサプレッサーが不明であったCarlavirus 属のウイルスが、2つのサプレッサー(CRPおよびTGBp1)を持っていることを明らかにしました。ウイルスベクターを用いた解析の結果、これらのサプレッサーはウイルスの感染過程の中で、複製と細胞間移行のそれぞれの段階を促進することがわかりました (Senshu et al., 2011)。よってCarlavirus 属ウイルスは、作用メカニズムの異なる2つのサプレッサーを使い分け、感染過程の複製と移行の各段階で宿主のRNAサイレンシングを個別に抑制し、自身の感染を容易にしている可能性が示されました。
このように様々なウイルスのサプレッサーを同定し、作用メカニズムを解析することは効果的なウイルスの防除戦略を立てる上で非常に重要です。
ウイルスの防除戦略として、RNAサイレンシングのような植物に本来備わっているウイルス防御機構を利用することが有効な手段の一つであると考えられます。実際に、RNAサイレンシングを利用したウイルス耐性作物の開発が世界各地で精力的に進められています。我々も、アブラムシにより伝搬されるPotyvirus 属ウイルスに対する耐性作物の開発により、RNAサイレンシングがウイルスを抑制する機構に関する知見を得てきました(Gonsalves et al., 1994; Namba et al., 1991c, 1992, 1994)。

1990年代には、ウイルスの遺伝子を導入することであらかじめウイルスに対するRNAサイレンシングを誘導したパパイヤが作出され、実用化されています。しかし、ウイルスのどの遺伝子を導入すると最も効果的にRNAサイレンシングを誘導できるのか、誘導したRNAサイレンシングをウイルスのサプレッサーに阻止されないようにするにはどうしたらよいか、など研究すべき課題は山積しています。
そこで我々は、PVXを用いて、ウイルスにコードされる遺伝子間でRNAサイレンシングを誘導する効果が異なるかどうかについて検討を行いました。PVXにコードされる移行タンパク質およびCPの遺伝子領域をdsRNAとして植物細胞内で発現させ、PVXに対するRNAサイレンシングの効果を比較しました。その結果、移行タンパク質をターゲットにした場合に効率的にPVXがRNAサイレンシングによって抑えられることがわかりました(Takahashi et al., 2006)。この結果はターゲットとする遺伝子領域によりRNAサイレンシングの効率が異なることを示しており、RNAサイレンシングを防除に応用する際に参考にすべき知見と言えます。
前述のようにRNAサイレンシングはウイルス防御機構としての役割以外に、植物の生育過程で働く様々な遺伝子の発現を制御しています。したがって、ウイルス感染時にサプレッサーはRNAサイレンシングを阻害することによって植物遺伝子の発現を攪乱し、植物の形態異常や生育不全を引き起こすと考えられます。サプレッサーの作用メカニズムを明らかにすることによって、ウイルス感染時に生じる様々な病徴の原因の一端が解明されることが期待されます。
RNAサイレンシングはdsRNAから生じたsmall RNAにより誘導される反応です。したがって、mycovirusなどのdsRNAをゲノムに持つウイルスはRNAサイレンシングを受けやすく増殖しづらいと推測されます。しかし実際には、dsRNAウイルスは様々な動植物に感染していることから、我々はdsRNAウイルスはRNAサイレンシングに対して独自の対抗戦略を備えているのではないかと考えました。我々は、ウイルス粒子を持つdsRNAウイルスであるmycovirusを用いて、RNAサイレンシングの影響を調べました。その結果、ウイルス粒子を持つdsRNAウイルスは、粒子を形成しないものと比較して宿主のRNAサイレンシングの影響を受けにくいことを見出しました(Himeno et al., 2010)。一般にウイルス粒子を持つdsRNAウイルスは粒子内で複製することが知られています。したがってdsRNAウイルスは宿主のRNAサイレンシングを回避する戦略の一つとして、粒子内で複製するようになったのではないかと考えています。
ウイルスの病原性発現機構
植物ウイルスの防除戦略の一つとして抵抗性遺伝子を導入した耐性植物が作出され重要な役割を担っています。植物ウイルスに対する抵抗性機構として、過敏感反応(hypersensitive response; HR)が最もよく知られています。HRにおいては抵抗性遺伝子(R遺伝子)がウイルスのタンパク質を基質として認識することによりウイルスの侵入を検知します。続いて、初期感染細胞において速やかにプログラム細胞死などの様々な反応が引き起こされウイルスの全身感染が阻止されます。
植物ウイルスに対する抵抗性育種のターゲットは、R遺伝子のような優性抵抗性遺伝子だけでなく、ウイルス感染に必要な翻訳伸長因子などの、劣性抵抗性遺伝子なども含まれます。しかしこれまで行われてきた抵抗性機構についての研究は個々のウイルスを対象とするにとどまっており、複数のウイルス種に共通した新たな抵抗性メカニズムの解明とその抵抗性育種への応用が求められています。
しかし抵抗性育種の一方で、抵抗性を打破する変異ウイルスの出現も問題となっています。抵抗性遺伝子による認識にはウイルス側の基質との相性が重要であるため、ゲノム変異を起こしやすいRNAウイルスは容易に抵抗性を打破することができるのです。このようなことから、我々は抵抗性メカニズムについての研究にとどまらず、ウイルス感染による病気が引き起こされるメカニズムにも関心を持って研究を行っています。我々はウイルス感染による発病メカニズムを分子レベルで明らかにすることにより、将来的にウイルス感染による病気を適切にコントロールする技術の開発を目指しています。
ウイルスの病徴決定因子
我々は、ウイルス感染による発病メカニズムを明らかにするために、ウイルスが持つ病徴を左右する因子(病徴決定因子)について多くの研究成果を挙げてきました。我々はタバコにおいて異なる病徴(輪状斑、モザイク、無病徴)を示すPVXの3つの分離株について、感染性cDNAクローンを用いて互いのゲノム領域を交換したキメラウイルスを作製することにより病徴決定因子を探索しました。その結果、これらの病徴の有無が複製酵素の1アミノ酸の違いによって決まることが分かりました(Kagiwada et al., 2005)。こうした、ウイルスゲノムのたった1塩基の変異によりウイルスの病原性が劇的に低下する例を、他にも我々はリンゴ高接病の病原ウイルスの一つであるapple stem grooving virus(ASGV)でも見出しています(Hirata et al., 2003; Lu et al., 2001; Ohira et al., 1995)。

このメカニズムには、おそらくRNAの2次構造によるリボソームのフレームシフトが関わっていると考えられ、興味深いところです(Hirata et al., 2010)。
全身壊死病徴の決定機構
植物ウイルスは植物にモザイク、黄化、壊死、奇形、萎縮など様々な病徴を引き起こしますが、そのなかでも最も激しく農業上の被害も大きいものが、植物体全身に壊死が引き起こされる全身壊死病徴です。我々は、ユリに壊そ症状などの甚大な被害を及ぼすPotexvirus 属ウイルスの一つ、plantago asiatica mosaic virus(PlAMV)がタバコ属植物(Nicotiana benthamiana)に引き起こす全身壊死病徴の決定機構を研究しています。PlAMVのLi1分離株はN. benthamiana に全身壊死を引き起す一方で、ウイルスは全身感染します。この壊死の組織を調べたところ、H2O2生成やイオン漏出など過敏感細胞死(HR)に特徴的な反応が確認されました。しかもこの全身壊死には、HRにより発現される抵抗性機構に特徴的な宿主因子「SGT1」、「RAR1」、「MAPKKKα」が関わっており、プログラム細胞死が引き起こされているとともに、壊死を引き起こすLi1分離株の蓄積が抑制されていました。これら一連の研究により、これまでウイルスの過剰な蓄積による非特異的な反応と考えられていた全身壊死症状が、植物の典型的な防御応答であるHRの一種であることが明らかになりました(Komatsu et al., 2010)。

また、この全身壊死症状を引き起すエリシターとして機能するウイルス因子も同定しました。PlAMV-Li1分離株にコードされるタンパク質を種々の組み合わせで植物において一過的に発現させた結果、複製酵素の単独発現により植物組織に壊死症状が誘導されました。さらに壊死誘導因子を絞り込んだ結果、ヘリカーゼドメインが壊死誘導因子であることが明らかになりました。
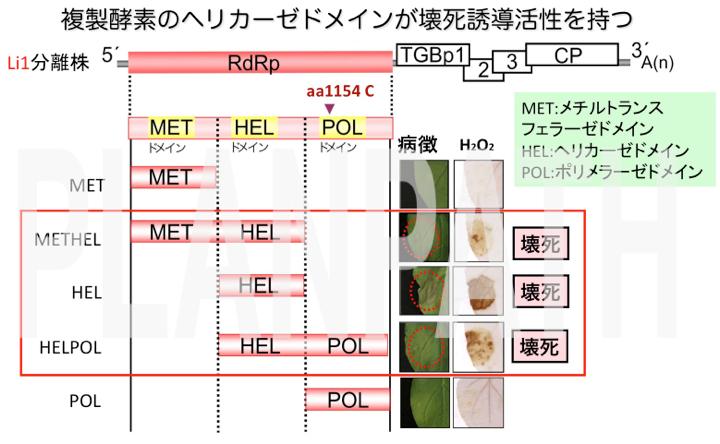
意外なことに、同一のユリ個体から分離された、植物に感染しても全く病徴を生じないLi6分離株についても複製酵素のヘリカーゼドメインはLi1と同様の壊死を誘導しました。両分離株の壊死誘導の可否は、ポリメラーゼドメインの1アミノ酸(aa1154)変異によりヘリカーゼドメインの壊死誘導能が制御されることにより決定されていると考えられます(Ozeki et al., 2006)。ヘリカーゼが壊死誘導決定因子であり、無病徴株もそれをコードしている、という新たな知見とその病徴発現機構の普遍性は注目され、本成果はMPMI誌(2011年の4月号)の表紙を飾りました(Komatsu et al., 2011)。

今後、全身壊死誘導機構の他の宿主―ウイルス間における普遍性を解明するとともに、壊死の生物学的意義の解明と、ウイルスの防除につながる技術開発に向け研究を進めたいと考えています。
レクチン抵抗性
植物ウイルスに対して効果的な耐性戦略を構築していくためには、植物がもつ多様な抵抗性メカニズムを明らかにし、植物が本来持つ「ちから」を最大限に利用する必要があります。私達はPlAMVを用いたモデル植物Arabidopsis thaliana のスクリーニングにより従来の抵抗性遺伝子とは異なる新規な抵抗性遺伝子JAX1を発見しました(Yamaji et al., 2012 Plant Cell)。

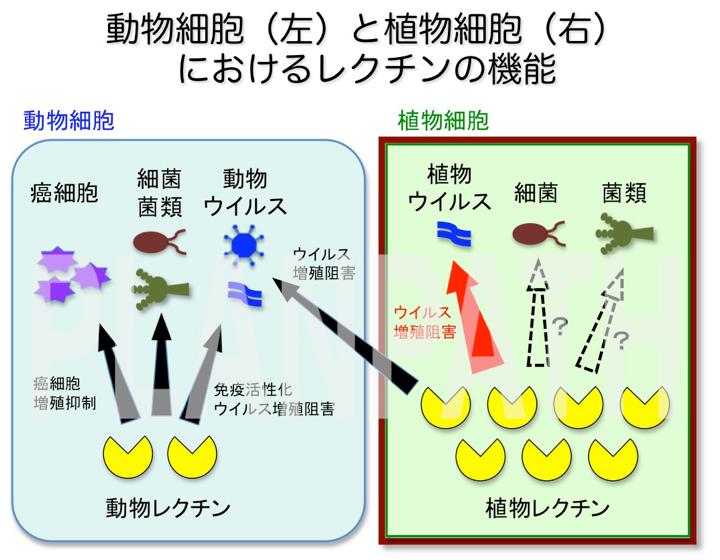
JAX1はジャックフルーツの主要成分であるジャカリンと似たレクチンの一種です。レクチンは糖鎖を認識して結合する性質を持ったタンパク質の一群で、19世紀後半に初めて植物から発見されました。その後、動物の免疫系を活性化したり、動物ウイルスや癌細胞を特異的に識別し増殖抑制する性質が明らかにされました。そもそもレクチンは植物で発見され、マメ科植物を中心に植物細胞で多量に蓄積するタンパク質であるにも関わらず、植物における働きはこれまであまり分かっていませんでした。

私達は、JAX1を持たないウイルス感受性の植物にJAX1を発現させたところ、ウイルスが全く感染できなくなりました。また、植物プロトプラストを用いて調べたところ、JAX1がウイルスの複製を阻害し抵抗性を示すことを発見しました。このことから、JAX1はウイルス感染の相当初期の段階で増殖を抑制する結果、強力な抵抗性を示すことが分かりました。さらにJAX1による抵抗性反応においては、HRに特徴的な細胞死や防御応答遺伝子などが誘導されず、またJAX1抵抗性にはRNAサイレンシングも関与していないことを明らかにしました。従って、JAX1によるウイルス抵抗性はこれまでにない新たな抵抗性であるといえます。私達はこれを「レクチン抵抗性」と名付けました。
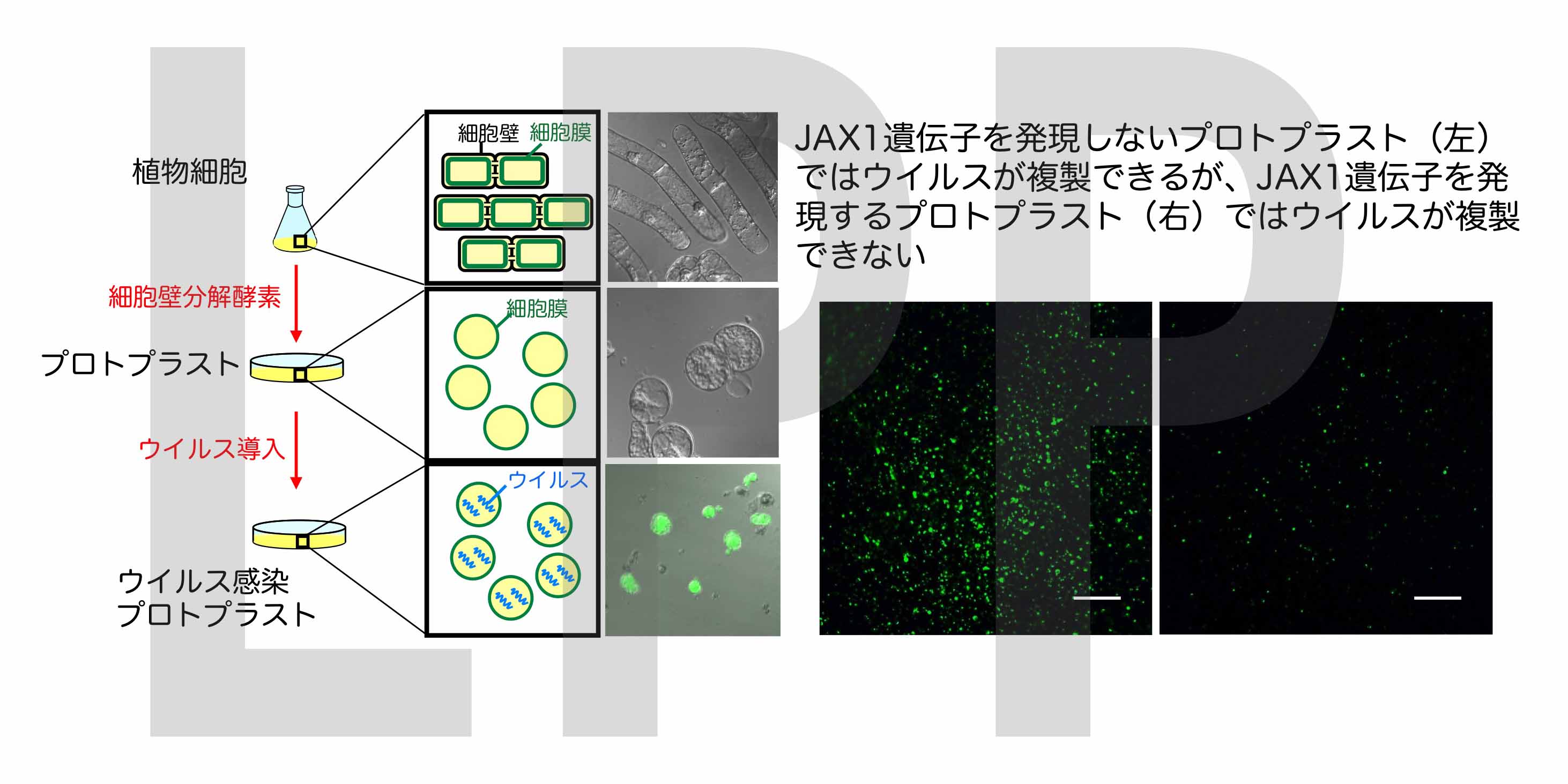
また私達は、JAX1がPlAMVだけでなくPVXなど農業上重要なウイルス40種以上で構成されるPotexvirus 属ウイルスに対して広域に強力な抵抗性を示すことを明らかにしました。従って、防除・予防薬剤のないウイルス病に対する抵抗性作物開発に利用することにより、ウイルス病被害が大幅に軽減されることが期待されます。
本研究の発表に続いて、植物病原菌類や細菌に対する植物の抵抗性反応にもレクチンが関与するという報告が立て続けになされています。このことは、レクチンが植物の防御応答において普遍的に重要な役割を果たす事を示唆するものであり、ウイルスに対するレクチン抵抗性の発見は病原微生物に対する植物の防御応答機構の全容解明につながる重要な一歩と言えます。また、JAX1の発見により動物のみならず植物においてもレクチンがウイルス防御タンパク質として働くことが明らかになりました。これにより、免疫システムの進化の解明やヒトに感染するウイルス特効薬開発への応用も期待されます。