ファイトプラズマ病とその病徴
ファイトプラズマはイネなどの作物を萎縮し枯らすほか、天狗巣病や葉化病など1,000種類以上の植物に病気を引き起こし、収穫を皆無にするなど、農業に甚大な被害を与える微小な植物病原細菌です(図1)(Namba, 2019 PJA Ser. B)。一方で、花を葉に変える葉化症状を呈する植物は少なくとも1000年前から中国王朝で朝貢品として扱われるなど、魅力的で付加価値の高い品種として珍重され、多くの関心を惹きつけてきました。また現代でも、市販のポインセチアは全て育種後にファイトプラズマを人為的に感染させられており、小振りで枝を密生する症状が商業的価値をもたらしています。このようなファイトプラズマにより植物に引き起こされる症状をまとめると次の様になります。
黄 化:葉に生ずる養分欠乏のような黄化症状
萎 縮:茎や葉の生長が抑制され、萎縮・矮化する症状
叢 生:側枝が異常に多く生ずる症状
てんぐ巣:側芽が異常に発生し、小枝や小葉が密生する症状
葉 化:花弁やがく・雌しべ・雄しべが葉に置き換わる症状
緑 化:花弁などで葉緑体が発達し緑色を帯びる症状

(Namba, 2019 PJA Ser. BのFig. 2を転載)
ファイトプラズマ研究の背景
わが国において、ファイトプラズマ病は少なくとも江戸時代には発生が記録され、養蚕に必要不可欠なクワでは萎縮病による甚大な被害が続いていました。養蚕は明治時代の最重要産業の一つであったため、1897年の帝国議会決議により調査委員会が設置され6年にわたる原因調査がなされましたが、過度な摘葉による生理障害と結論され、真の原因解明には70年もの年月を要しました。1967年、東京大学植物病理学研究室の土居らは電子顕微鏡を用いて、クワ萎縮病等の多くの発病植物の篩部細胞に径約0.1ミクロンの微小細菌が局在することを世界で初めて発見し、テトラサイクリンにより治癒することから動物マイコプラズマに似た微生物MLO(Mycoplasma-Like Organism)と命名しました(図2)。その後世界中でMLOの存在が追認され、少なくとも1,000種類以上の植物に感染し、食料生産確保・環境保全の両面において世界中で甚大な被害をもたらすことが明らかになりました。MLOはヨーロッパのブドウやリンゴ、東アジアのナツメなどの果樹生産において大きな脅威になっており、赤道地帯のココヤシや東南アジア一帯のイネやサツマイモ、キャッサバ、サトウキビなど、開発途上国の農業生産に壊滅的被害をもたらしています。
この新たな病原体の一群の発見は、農学のみならず、生物学の新ジャンルを拓く成果として世界中の注目を集めました。しかし、それから約半世紀を経ても培養法や形質転換系は確立されておらず、遺伝子レベルでの研究は遅れており、MLOの実態は長年にわたり不明でした。

図2 植物・昆虫に感染したMLO粒子
MLOからファイトプラズマへ─ファイトプラズマ分子分類体系の確立
MLOの生物分類学的位置づけは長年不明で、MLO同士の関係性についても、形態が類似し培養もできないことから、判別できませんでした。そのため、MLO病の発生が確認されると、宿主植物の種類ごとにMLOの名称(系統名)が与えられていました。その結果、国内で約60種類、世界で1,000種類以上もの系統が報告される状況になり、MLOの明確な整理・分類の基準が必要とされていました。こうした状況の中、当研究室においてMLOの分子レベルでの研究が開始されました(Namba et al., 1993a, b)。当時、分子生物学的な手法による系統分類法が考案されはじめており、当研究室では世界各地に発生するMLOの16S rRNA遺伝子のPCR増幅系を確立し分子系統解析をおこないました。その結果、MLOはMollicutes(モリキューテス)綱に分類される、分子系統学的に独立した一つの集団であることが明らかになりました(図3)。従来MLOと称されてきた本微生物が動物マイコプラズマとは独立した集団であることが示されたため、MLOというそれまでの名称をファイトプラズマに変え、属名を Phytoplasma とすること、分子系統解析により分類されたサブグループについて、ラテン二名法により暫定種を命名すること等が提案され、承認されました(Namba et al., 1993b)。その後、暫定種の登録が進められ(Sawayanagi et al., 1999; Jung et al., 2002, 2003a, 2003b; Miyazaki et al., 2018)、現在では国内で11種、世界で約50種に整理が進んでいます。

図3 ファイトプラズマはマイコプラズマとは系統学的に異なる
ファイトプラズマの全ゲノム解読
分類基準の制定により、ファイトプラズマの分子レベルでの研究が世界中で展開されることとなりました。ファイトプラズマの性状解明の手がかりをつかむために次の目標となったのはゲノム解析でした。世界各国でゲノムプロジェクトが進行するなか、2004年、当研究室において、世界で初めてファイトプラズマの全ゲノム解読に成功しました(Oshima et al., 2004 Nature Genetics)。

図4 ファイトプラズマの全ゲノムマップ
これは、日本初の植物病原細菌の全ゲノム決定の事例でもありました。ファイトプラズマゲノムは、DNA複製や転写、翻訳に必要な基本的遺伝子を保持する一方で、アミノ酸合成系、脂肪酸合成系、TCA回路、酸化的リン酸化に関与する遺伝子を欠き、さらにペントースリン酸回路やPTS(糖輸送系)、ATP合成酵素に関する遺伝子も欠いていて、自律増殖する生物において最少遺伝子を持つとされるマイコプラズマより代謝関連遺伝子が少ないことが判明しました。これはファイトプラズマがマイコプラズマと異なり、細胞内寄生で栄養豊富な植物篩部に生息するため、退行的進化により遺伝子の多くを失ったためと考えられました(図4)。逆に、ファイトプラズマゲノムには、マイコプラズマには無い膜輸送系遺伝子が多数コードされていました(図5)。アミノ酸や糖、リンゴ酸などのほか、各種金属イオンの取り込みに関わる膜輸送系が数多くコードされ、植物の生育に必要なこれら金属イオンがファイトプラズマの感染により宿主から収奪され、ファイトプラズマ病に特徴的な病徴である養分欠乏に似た症状を引き起こす一因になっていると考えられました。本成果により、ファイトプラズマ研究のステージは一気にポストゲノム研究へと押し上げられることとなりました。

図5 ファイトプラズマ代謝経路
赤字はマイコプラズマが持つがファイトプラズマが持たない代謝系路。
青字はファイトプラズマが持つがマイコプラズマが持たない膜輸送・代謝系路
媒介昆虫を決定する分子メカニズム
ファイトプラズマは、系統ごとに特定のヨコバイにより媒介され、他のヨコバイにより媒介されることはありません。人の病原体であるマラリアを含め、多くの昆虫媒介性病原体は特定の昆虫によって媒介されますが、その特異性を決めているメカニズムはこれまで不明でした。そこで、ファイトプラズマの媒介昆虫特異性のメカニズムを解明する目的で、ファイトプラズマの昆虫体内における局在を組織・細胞レベルで解析しました。ファイトプラズマの細胞膜上に豊富に存在するAmpタンパク質を指標にファイトプラズマの時空間動態を三次元的に可視化することで、ファイトプラズマがヨコバイの消化管に感染して増殖した後に全身へと広がり、唾腺や脳に感染することを明らかにしました。さらに消化管と唾腺における分布変化を詳細に捉えることで、臓器内でファイトプラズマが感染する組織に偏りがあることが明らかになり、主な侵入・増殖部位や移行時期を特定しました(図6)(Koinuma et al., 2020 Scientific Reports)(プレスリリース)。

図6 ファイトプラズマの昆虫への全身感染ダイナミクス
さらに、Ampを結合させたアフィニティーカラムを作製し、これを用いてAmpと相互作用する昆虫宿主タンパク質を同定したところ、Ampは媒介昆虫の細胞骨格であるマイクロフィラメントを構成するアクチンやミオシンと複合体を形成することが明らかになり、このAmp–マイクロフィラメント複合体(AM複合体)形成は媒介能のある昆虫に特異的だったことから(図7)、ファイトプラズマの媒介昆虫決定に大きく関与することが明らかになりました(図8)(Suzuki et al., 2006 PNAS)(プレスリリース)。

図7 AM複合体を形成する昆虫がファイトプラズマを媒介できる

図8 掲載されたPNAS表紙
さらに私達は、全ゲノム解読をおこなったOY-M系統をもとに、昆虫による媒介能を喪失させたファイトプラズマ系統OY-NIM(non-insect-transmissibility)を作出し(Oshima et al., 2001)、異なる切り口からも昆虫媒介のメカニズムの解析を進めました。OY-M系統と遺伝子情報を比較したところ、興味深いことに、OY-NIM系統のゲノム上の配列には変異が見出されなかった一方で、プラスミド上にコードされる膜タンパク質ORF3が失われていることが明らかになりました(図9)(Nishigawa et al., 2002; Ishii et al., 2009a, b)。この結果から、Ampに加えてORF3も、昆虫媒介性において重要な役割を持つ膜タンパク質であると考えられました。
また、宿主への接着に関わると考えられる膜タンパク質の解析を行いました。多くの病原細菌は宿主細胞への接着・侵入の際に,菌体表面の接着因子が重要な役割を果たします。ファイトプラズマに近縁なマイコプラズマなどの接着因子にみられる、配列保存性の高いアミノ酸モチーフ Mollicutes Adhesin Motif(MAM)に着目し、MAMの配列情報を手がかりにファイトプラズマの接着因子ホモログを探索しました。その結果、MAM領域を持つ膜タンパク質P38を見つけ、宿主昆虫粗汁液に対してMAMモチーフ依存的な接着能を示すことを明らかにしました(Neriya et al., 2014)。

図9 昆虫媒介能を喪失したOY-NIMはプラスミド上のORF3を喪失
植物にてんぐ巣症状を誘導する病原性低分子ペプチド「TENGU」
てんぐ巣や葉化などのユニークな病徴は、ファイトプラズマ研究において最も興味深いテーマの一つです。ファイトプラズマが菌体の外へと分泌するタンパク質は、宿主細胞内に直接放出され、宿主細胞の代謝系に直接的に働きかけることができるため、病徴を誘導する病原性因子の最有力候補と考えられました。そこで、ファイトプラズマゲノムにコードされる分泌タンパク質遺伝子に焦点をあて、その病徴誘導活性のスクリーニングをおこないました。その結果、分泌タンパク質のうちの一つを発現させた植物において、草丈の伸長が抑えられる「萎縮症状」と、枝分かれが異常に増加する「叢生症状」が認められ、これらの症状はファイトプラズマ感染植物と酷似していました(図10)。 萎縮・叢生症状を呈する植物は、日本では古来より「てんぐ巣病」と呼ばれていたことから、萎縮および叢生症状を誘導するこの分泌タンパク質をてんぐ巣病の誘導因子「TENGU」と命名しました。TENGUはわずか38アミノ酸からなるタンパク質で、植物に形態変化を誘導する植物病原細菌由来のペプチド性因子は、世界で初めての発見でした。ファイトプラズマは篩部局在性ですが、ファイトプラズマ感染植物組織におけるTENGUの動態を調べたところ、TENGUは植物の茎頂分裂組織(成長点)や側芽の分枝領域の細胞にまで移行していることが分かりました。また、TENGUを発現する形質転換植物において特異的に発現が変動する植物遺伝子群を、マイクロアレイ解析によって特定した結果、植物ホルモンの一つであるオーキシンに関連した遺伝子群の発現レベルが大きく低下していました。以上の結果より、TENGUはファイトプラズマから分泌された後、周囲の細胞や茎頂分裂組織へと移行し、オーキシン関連経路を抑制して植物の形態形成に影響を与えることにより、てんぐ巣症状を引き起こすことが示唆されました(図11)(Hoshi et al., 2009 PNAS)(プレスリリース)。

図10 TENGUは植物にてんぐ巣病を引き起こす

図11 TENGUのてんぐ巣病誘導モデル
さらに私達はTENGUの病徴誘導領域を絞り込み、全長38アミノ酸のうちN末端側のわずか11アミノ酸がてんぐ巣症状を引き起こす活性を持つことを明らかにしました(図12)。そこで、TENGUが植物内で切断される可能性を検証したところ、実際にin vitro と in planta の両条件下で、TENGUが切断されることが分かりました。ペプチドシーケンス及びTOF-MSを用いた解析から切断部位の特定をした結果、N末端側は病徴誘導領域である11アミノ酸を含む断片として生成されることが明らかになりました。また、TENGUの切断は植物が持つセリンプロテアーゼによることがわかりました。加えて、TENGUのファイトプラズマ間における保存性を解析したところ、主要グループの1つであるAYグループにおいてアミノ酸配列や機能、被切断特性が広く保存されていることが明らかになりました。以上の結果から、TENGUは植物内で切断され、そのN末端側のペプチドがてんぐ巣症状を誘導すること、さらにその誘導機構が複数のファイトプラズマに保存されていることが示唆されました(Sugawara et al., 2013 Plant Physiology)。

図12 てんぐ巣症状誘導活性を持つTENGUの領域
一方、ファイトプラズマに感染した植物は、しばしば種子を作れず子孫を残せない「不稔症状」を伴った病徴を引き起こします。不稔症状は、果実や種子の生産に致命的な被害を与える重大な病気の一つですが、その原因物質やメカニズムについてはこれまで不明でした。当研究室では、不稔症状を引き起こす病原性因子がTENGUであり、一つの病原性因子が「てんぐ巣」と「不稔」という2つの異なる症状を引き起こす、非常に興味深い現象を突き止めました。植物にTENGUを発現させると、花粉が奇形となり、雄性不稔症状が起こることを発見しました(図13)。TENGUを発現させた植物の花芽では、花の稔性に関わる複数の植物ホルモン(ジャスモン酸およびオーキシン)の蓄積量が低下することが明らかになりました。さらに、ジャスモン酸の発現に必要な2つの遺伝子、AUXIN RESPONSE FACTOR 6 (ARF6) およびARF8 の発現量が、TENGU発現植物およびファイトプラズマ感染植物いずれにおいても抑制されることを明らかにしました。従って、ファイトプラズマに感染した植物では、TENGUの作用により植物のARF6およびARF8の発現が抑制され、植物ホルモン量が低下し、不稔症状を引き起こすと考えられました。このようにTENGUは2つの異なる植物ホルモンに作用するという、病原性因子としてこれまでに例のないユニークな機能を持つことが明らかになりました(Minato et al., 2015 Scientific Reports)。

図13 TENGU発現植物の不稔と花粉成熟不全
ファイトプラズマが花を葉に変えるメカニズム
花が葉になる「葉化(phyllody:phyllo-(葉)+ -ody(になる変化))」や、花から若芽が出現する「つき抜け」などの花器官における病徴も、ファイトプラズマが引き起こす非常にユニークな病徴です。花の形態形成に関わる植物の遺伝子群の中でも特に各花器官(がく、花びら、雄しべ、雌しべ)の形成を制御するA、B、C、D、E遺伝子に着目し、ファイトプラズマの感染による影響を解析しました。A~Eにより表されるこれらの遺伝子はいずれもMADSドメイン転写因子をコードしており、それらがヘテロ四量体を形成する際の組合せにより、各花器官への分化が決定されます(カルテットモデル)。葉化症状が見られた花器官では、そのヘテロ四量体の形成に必要な遺伝子の一部の発現量が有意に減少していることが判明しました(Himeno et al., 2011 the Plant Journal)(プレスリリース)。興味深いことに、発現量が減少した遺伝子の種類に一貫性はなく、例えば葉化したがくでは、がくの形成に必要とされるA、E遺伝子のうち、A遺伝子の発現が抑制されていた一方、同じく葉化の見られた花びらでは、花びらの形成に必要とされるA、B、E遺伝子のうち、A遺伝子ではなくB遺伝子の発現が抑制されていました(図14)。

図14 花形成遺伝子のファイトプラズマ感染によるノックダウン
では、ファイトプラズマは花の形成に関わる遺伝子群に関して花器官ごとに巧みに発現制御をおこなうことによって、葉化を引き起こしているのでしょうか。私たちはむしろ、もっと根源的な作用点があり、その結果として各花器官に異なる影響が現れているのではと考えました。しかし、花器官の形成に関わる転写制御ネットワークはきわめて複雑でまだ解明に至っておらず、植物側から作用点に迫ることは困難でした。そこで、ファイトプラズマ側からのアプローチにより葉化の原因に迫ることを目指しました。その結果、花が葉になる葉化症状の原因遺伝子が、ファイトプラズマゲノムに共通して存在することを発見し、「ファイロジェン (PHYLLOGEN, Phyllody-inducing gene family(葉化誘導遺伝子ファミリー)の略)」と命名しました。ファイロジェンは、わずか91アミノ酸の分泌タンパク質をコードしており、植物において発現させると、ファイトプラズマによる症状と同様に花が葉化しました(図15)。ファイロジェンの働きを調べたところ、まずMADSドメイン転写因子群のうち少なくともA、Eの転写因子に結合する性質を持っていることが分かりました。そこで、実際にA、E転写因子をファイロジェンとともに植物細胞に導入したところ、それら転写因子が分解されることが明らかになりました。また、タンパク質分解装置(プロテアソーム)を阻害するようにあらかじめ処理すると転写因子の分解が阻害されたため、ファイロジェンが植物のプロテアソームを利用してMADSドメイン転写因子群を分解していることが確かめられました。また、A、E転写因子はB転写因子の発現を誘導するのですが、ファイロジェンを発現させた植物では逆にB転写因子の発現が抑制されていました。つまり、A、E転写因子が細胞内で分解されたため、B転写因子の誘導が阻害されたと推定されます(図16)。以上の結果から、ファイトプラズマに感染しファイロジェンが分泌された植物では、各花器官の形成に必要なカルテットモデルを構成する転写因子の多くが、分解または発現抑制され、これが原因で各花器官の葉化が起こり、花から新たに枝葉が形成されることが説明されます(Maejima et al. 2014 Plant Journal)(プレスリリース)。

図15 掲載されたPlant Journal表紙

図16 ファイロジェンによる葉化の分子メカニズム
さらに、ファイロジェンには様々な植物の花を葉化させる活性があり(図17)、単子葉植物や裸子植物、シダ植物のMADS転写因子までも結合し分解する活性があることがわかりました。この結果は、ファイロジェンがあらゆる植物に対して花を葉化させる機能を持つことを示しています(Kitazawa et al., 2017 J Exp Bot)(プレスリリース)。X線結晶構造解析によりファイロジェンの立体構造を解明した結果、2つのαヘリックスによるコイルドコイル構造を形成しており、標的のMADSドメイン転写因子の四量体化部分の構造に類似していることが明らかになりました(図18)(Iwabuchi et al., 2019)(プレスリリース)。

図17 ファイロジェンはあらゆる植物の花を葉化させる

図18 ファイロジェンの構造決定
ファイトプラズマの多様な種や系統がもつファイロジェンの配列を比較したところ、ファイトプラズマ間でファイロジェンの立体構造は保存されているものの、これまで想定されていた以上に配列多様性に富み、ファイトプラズマとは独立に進化していることが示されました。その原因として、ファイトプラズマ間でファイロジェン遺伝子の水平移動が起きていたことが明らかになりました。また、機能の比較解析により、ファイロジェンが進化の過程で葉化を引き起こす「葉化型」と引き起こさない「非葉化型」のグループに機能分化していることを明らかにしました。そこで非葉化型に特徴的なアミノ酸残基に着目したところ、立体構造の中で64番目のアミノ酸がMADS転写因子への結合・分解と葉化を引き起こすかどうかを決定していることが明らかになりました。このことは、ファイトプラズマによる葉化病がファイロジェンという単一のタンパク質の、わずか1アミノ酸の変異によって決定されていることを示しています。(図19,20)(Iwabuchi et al., 2020 Mol. Plant Pathol.)(プレスリリース)。

図19 掲載されたMol. Plant Pathol.表紙
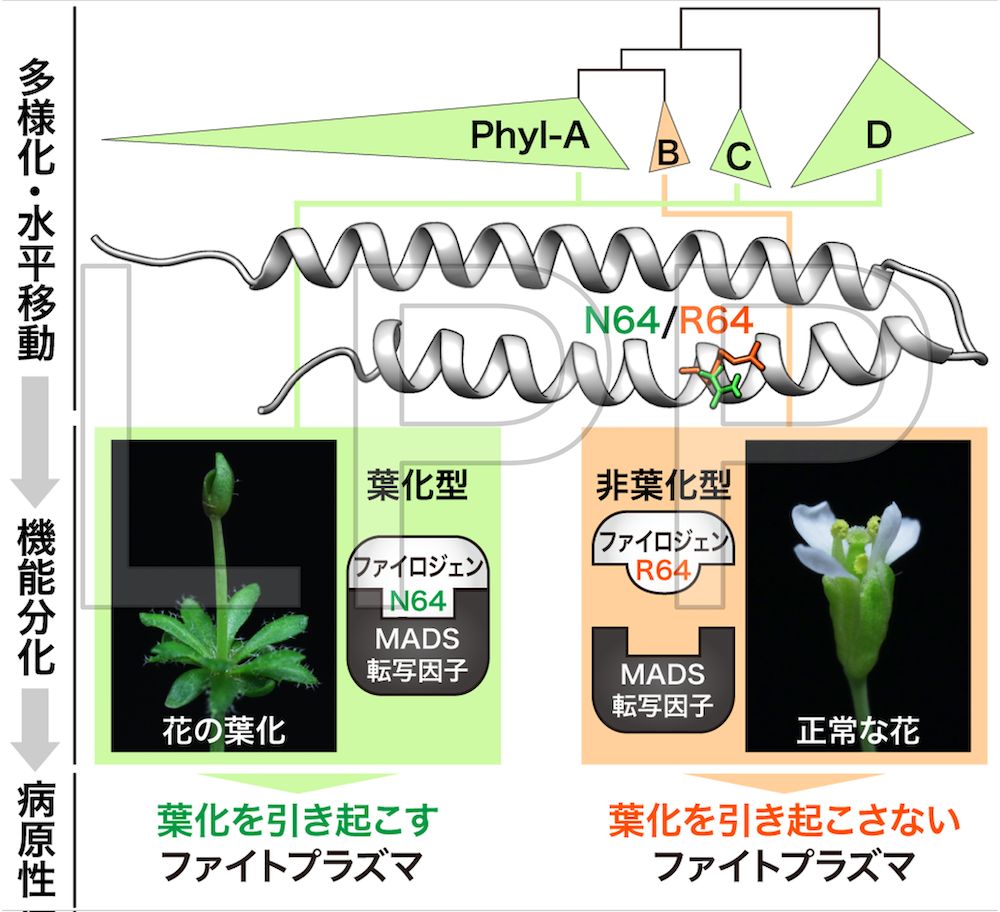
図20 ファイロジェンの機能的多様性は1アミノ酸により決定される
私たちは、ファイロジェンによるMADS転写因子分解の詳細な分子メカニズムについても解析しました。一般にプロテアソームの標的タンパク質にはユビキチンタンパク質が結合(ユビキチン化)し、ユビキチン化タンパク質とプロテアソームの両方を認識するシャトル分子によってプロテアソームへと運ばれ、分解されます。ファイロジェンによるMADS転写因子分解にもユビキチンの関与が疑われていましたが、ファイロジェンと宿主因子の相互作用を解析した結果、ファイロジェンはMADS転写因子とシャトル分子の一種RAD23に同時に結合することで、ユビキチンの代わりに両者の相互作用を直接仲介し、MADS転写因子をプロテアソームへと運ばせることがわかりました。即ち、ファイロジェンはユビキチンを機能的に模倣し、標的因子のユビキチン非依存的なプロテアソーム分解を誘導すると考えられました。このようなユビキチン非依存的なプロテアソーム利用メカニズムは、他種細菌には未発見の新たなしくみです。(図21)(Kitazawa et al., 2022 Plant Cell)(プレスリリース)。

図21 ファイロジェンはユビキチンの代わりに標的をプロテアソームに輸送する
これらの研究は分子レベルで葉化症状の原因を説明づけた世界で初めての成果となりました。得られた成果は、植物の花器官形成メカニズムの解明にもつながる普遍性があり、園芸品種の育成に応用することで病原体フリーの葉化品種の開発も期待されています。
動物・植物間のホストスイッチングに伴う環境適応
ファイトプラズマは昆虫−植物の宿主間を水平移動する「ホストスイッチング」により感染を拡大します。昆虫と植物という全く異なる生物界の宿主に寄生する能力には興味が持たれてきましたが、その仕組みはこれまで謎に包まれていました。ホストスイッチングにはファイトプラズマの遺伝子発現の切り替えが伴うと予想されたため、それら遺伝子を網羅的に調べるためマイクロアレイを作製しました。マイクロアレイ解析の結果、ファイトプラズマは植物宿主と昆虫宿主とを移動するたびに、ゲノム全体の約1/3に相当する遺伝子の発現量を切り替えていることが明らかになりました(図22)(Oshima et al., 2011 PLoS One)(プレスリリース)。特に、ファイトプラズマはそれぞれの宿主に合わせて、物質輸送を行うトランスポーターや浸透圧を調節するチャネル、糖を分解する酵素、宿主細胞内で働く分泌タンパク質などを巧みに使い分けている点に興味が持たれました。そこで、実際に植物感染時に働く浸透圧調節チャネルの機能を、阻害剤を用いて抑制したところ、ファイトプラズマの増殖を部分的に抑えることに成功しました。この結果は、ホストスイッチングの阻害・抑制が、特効薬が無く防除や予防が困難なファイトプラズマ病の新規防除法につながる可能性を示す成果です。 このように、ファイトプラズマはホストスイッチングに伴いダイナミックに遺伝子の発現を切り替えていることが明らかとなったため、次にファイトプラズマの遺伝子発現制御機構について研究を進めました。多くの細菌は、周囲の環境変化に応じてσ(シグマ)因子と呼ばれる転写因子を使い分けることで遺伝子発現を制御しています。ファイトプラズマはRpoDとFliAという2種類のσ因子を持ちますが、中でもRpoDはファイトプラズマ間で保存性が高い上に昆虫体内で特に発現量が上昇するため(Oshima et al., 2011 PLoS One)、ホストスイッチングに関与する可能性が考えられました。そこで、in vitro でのRNA転写系を構築し、ファイトプラズマのRpoDにより発現制御される遺伝子を解析しました。その結果、ハウスキーピングな遺伝子に加えて、病原性や宿主相互作用に関わる様々な遺伝子の発現を制御していることが明らかになりました(Miura et al., 2015 Scientific Reports)。また、他の全ゲノム解読されたファイトプラズマにおいてもRpoDに同様の活性があることを、in silico 解析により明らかにしました。RpoDは一般に、恒常的に発現してハウスキーピング遺伝子の発現を司るσ因子として知られていましたが、本研究により、ファイトプラズマのRpoDは他の細菌よりも複雑な機能を担うことが示唆されました。さらに、ファイトプラズマゲノムから転写されるRNAを網羅的に調べたところ、遺伝子をコードしないRNAも多数生じていることが明らかになり、複雑な転写制御の一端を担っていると考えられました(Nijo et al., 2017 DNA Cell Biol)。これらは、ゲノムの退行的進化により獲得された遺伝子発現制御機構であると考えられ、ファイトプラズマのホストスイッチング機構の解明に繋がる重要な成果であると考えられます。

図22 ホストスイッチングに伴うファイトプラズマ遺伝子発現変動
世界初の診断キットと治療薬の探索
ファイトプラズマ病は昆虫の媒介により広がっていくため、その被害を防ぐには早期に診断をおこない、感染源や媒介昆虫を取り除くことが重要です。しかし、ファイトプラズマは培地上で培養できず、通常の顕微鏡では見えないほど微小なため、当初のファイトプラズマ病診断は電子顕微鏡に頼るしかなく、近年になりようやくPCRによる遺伝子診断系が確立されました。ただ、PCRによる診断には高度な研究設備が必要とされ、フィールドや開発途上国におけるファイトプラズマ病の早期診断は依然として困難でした。私たちは、全ゲノム情報をもとに世界各地のファイトプラズマの遺伝子配列データを解析し、等温遺伝子増幅技術LAMP法によるあらゆるファイトプラズマを検出可能なキットを世界で初めて開発しました(プレスリリース)。お湯があればどこでも約1時間で診断可能で、従来のPCRより1000倍も高感度であり、試薬の乾燥化により常温での輸送や保管が可能です(図23)(プレスリリース)。このキットは、国内だけでなく東南アジア・オセアニア地域のファイトプラズマ病の解決のために利用が始まっています。

図23 迅速・超高感度・可搬性のユニバーサル診断キット
これまでファイトプラズマ病に効果的な治療薬は、土居らにより確認されたテトラサイクリン以外にないと考えられていましたが、私たちは治療薬の探索技術を独自に開発し、複数の治療薬を発見しました(図24)。これらの治療薬を継続的に用いると、植物からファイトプラズマを完全に除去できることもわかってきました(Tanno et al., 2018)(プレスリリース)。

図24 ファイトプラズマ病の治療薬の探索
ファイトプラズマ研究のこれから
私たちの研究により、ファイトプラズマ研究に分子のメスが入ってから約30年、全ゲノム解読から約20年が経過しました。この間、ファイトプラズマ研究は目覚ましい勢いで進展し、当研究室も多くの貢献を果たしてきました。特にポストゲノム研究により、当初は想像もできなかったようなファイトプラズマの実態が次々と解明されてきました。しかし、明らかになった部分はまだほんの一部であり、依然としてその性状は謎に包まれています。例えば、ファイトプラズマの極限にまで切り詰められてもなお生命を維持する代謝系の動植物宿主との物質のやり取りを通じた動的解明はこれからが本番です。また、ファイトプラズマが植物に引き起こすユニークな病徴の生物学的意義や植物・ファイトプラズマの共進化の意義、植物宿主域の決定メカニズムの詳細も未解明です。そして、宿主である植物・昆虫のファイトプラズマ感染に対する防御応答や共生のメカニズムも解明が待たれます。私たちの研究領域はさまざまな分野へと広く開かれており、ボーダーはありません。世界の食料生産・森林資源・農地・緑地・住地環境に甚大な被害と脅威を与え続けているファイトプラズマ病の新たな治療・防除・予防技術の確立に向けて、今後もさらに研究を飛躍させていきます。

