はじめに
我々のグループでは、微生物を生命科学研究において「有用な解析ツール」を提供してくれる供給源として位置づけ、それを利用することで神経細胞の分化と生存を支える「神経栄養因子」の研究分野において独創的な領域を開拓することを目指した研究を行っています。また、最近はそれ自身が有用微生物である麹菌の分泌酵素に関する研究も行っています。
研究の背景と概要
近年、我が国においても高齢化に伴う認知症や様々な神経疾患が深刻な社会問題になりつつありますが、これらの病気は基本的に脳の神経細胞が失われることにより引き起こされます。しかし、例えば肝臓なら、肝細胞は再生する(細胞分裂する)能力を保持しているので、いったん傷ついた組織でも元の状態に回復しますが、哺乳類の神経細胞はそのほとんどが胎生期に分裂能力を失ってしまっているため、それは不可能です。また、一つの神経細胞は約1,000個のシナプス(別の細胞との連絡部位)を持つと言われているように、神経系は極めて複雑な回路から成り立っているので、これを再構築することも大変困難です。従って、神経細胞をできるだけ「長生き」させるのが脳機能を維持する最も有効な手段であると言っていいでしょう。
胎生期に分裂を終えた神経細胞はその後ほぼ一生の間生存し続けますが、その長い寿命を支えているのが神経栄養因子と総称されるタンパク質群です。これらは神経細胞の分化や生存、あるいはその活動を様々に調節しています。最初に発見されたものは神経栄養因子Nerve Growth Factor (NGF)と呼ばれるタンパク質で、いくつかの幸運な偶然が重なったことで発見されました。その後、この発見が契機となってニューロトロフィンファミリーをはじめとする様々な神経栄養因子類が発見され、「神経細胞の生存には神経栄養因子の存在が必須である」という認識が確立されました。しかし神経系の多様さ・複雑さに比べその数はごく限られており、未知の神経栄養因子はまだまだたくさん存在すると考えられます。
一方、私たちは微生物が多彩な化合物を作る能力があることに着目し、微生物由来の様々な未知生理活性物質の中に神経栄養因子のような活性を持つ物質が存在するのではないかと期待しました。そして、もしもそのような物質を見出すことができれば、これまで発見されていなかった新しい仕組みによって神経細胞が活動し、生存することを明らかにし、それを利用して神経細胞死を予防する新しい手段を開発することもできるのではないかと考えました。これが最初に述べた「微生物由来の有用な解析ツールの利用」をより具体的に述べたものです。私たちはこうした発想から、微生物代謝産物を対象に神経栄養因子のスクリーニングを行いました。その結果、全く予期しなかったことに、分泌型ホスホリパーゼA2(以下sPLA2と略)と呼ばれるタンパク質がそうした作用を示すことを見出しました(図1、図2)。「予期しなかった」というのは、この酵素は動物にも存在することはわかっていましたが、神経栄養因子として働くことはこれまで全く報告されていなかったからです。また最近、その作用機序も非常にユニークなものであることが分かってきました。これらの点で、我々の行っている研究は他の誰も行っていない、極めて独創性の高い研究であると信じています。
図1 sPLA2の神経細胞に対する作用
| 上段: | PC12細胞はNGF処理によって分化し、神経突起を伸長させる。sPLA2処理によっても同様に突起伸長する。 |
| 下段: | 初代培養した後根神経節細胞は、その生存にNGFを必要とし、NGF非存在下ではアポトーシスする。sPLA2はNGFと同様にこのアポトーシスを抑制する。 |
高カリウム培地
低カリウム培地
低カリウム培地
+ sPLA2 (p15)
低カリウム培地
+ ヒトsPLA2-X
図2 sPLA2の中枢神経細胞に対する栄養因子効果
小脳顆粒ニューロンはその生存に高濃度カリウムによる脱分極刺激を必要とし、低カリウム培地ではアポトーシスが誘導される(矢印の細胞など)。ここにsPLA2であるp15やヒトグループX sPLA2を添加するとアポトーシスが抑制される。
分泌型ホスホリパーゼA2(sPLA2)とは?
「ホスホリパーゼ」はその名の通りリン脂質を加水分解する酵素です。分解様式によって様々なタイプが知られていますが、「ホスホリパーゼA2」はグリセロリン脂質の2位のエステル結合を加水分解し、脂肪酸と1-アシル型のリゾリン脂質を生成する酵素です(図3)。さらに、同じ酵素活性を示すがその局在や生理機能の異なる「分泌型 (sPLA2)」、「細胞質型 (cPLA2)」、「カルシウム非依存型 (iPLA2)」などのファミリーが知られています。sPLA2は他の二つが細胞内で働くのに比べ、細胞外に分泌され、細胞の外から膜に作用すると考えられています。
図3 ホスホリパーゼA2
研究内容
1. sPLA2の持つ神経栄養因子活性の作用機序の解析
従来sPLA2は膜脂質からアラキドン酸を遊離させることによって、多彩な生理作用を有するエイコサノイド類(プロスタグランジン、ロイコトリエン等)の産生を促進する酵素として詳細に研究されてきた。しかし、sPLA2が神経栄養因子としての働きを持つことは全く報告されておらず、我々がスクリーニングという手段を用いることで初めて明らかにすることができた新規な作用である。さらに最近、その神経栄養因子作用がエイコサノイド生成によるものではなく、もう一つの産物であるリゾリン脂質、特にホスファチジルコリンが分解してできるリゾホスファチジルコリン (LPC) の産生を介したものであることが強く示唆された。興味深いことに同様の作用はLPCだけでなくもう一つのコリン含有型リゾ体のスフィンゴ脂質であるスフィンゴシルホスホリルコリン (SPC) にも見られるが、他ヘッドグループを持つリゾリン脂質、例えば強力な細胞増殖促進効果を示すことが知られているリゾホスファチジン酸などには全く活性がない。近年、LPCやSPCに対する特異的なGタンパク質共役型受容体 (OGR1サブファミリーGPCR) が発見されたが、我々はsPLA2からのシグナル伝達にこれらOGR1サブファミリーGPCRが関与する可能性を見出している(図4)。本研究は上記のような我々独自の研究成果に基づき、これまで全く未知であったsPLA2、LPCやSPCの神経系における生理機能、およびその分子メカニズムを明らかにすることを目的としている。
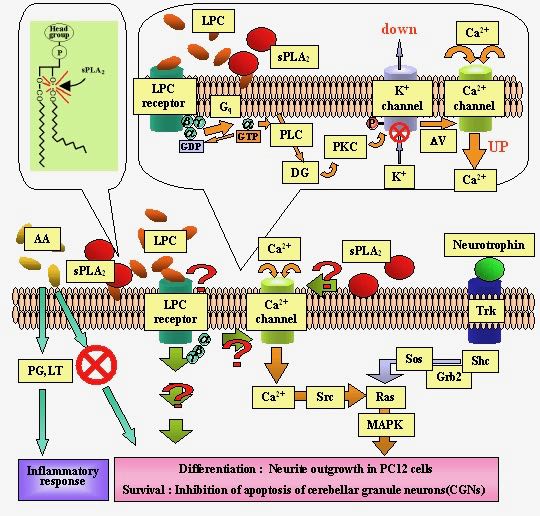
図4 予想されるsPLA2の神経栄養因子様作用の作用機構
2. ほ乳類sPLA2の神経系における役割と分布
ゲノム解析の結果、ほ乳類はsPLA2遺伝子を各々約10個ずつ持つことが明らかにされている(図5)。しかし、それらが重複した機能を持つのか、あるいは役割分担があるのかについてはまだあまりよく分かっていない。我々はほ乳類sPLA2のうちグループVとXが上述したような神経栄養因子用の活性を持つこと、逆に消化酵素として知られるグループ IBや炎症反応に関与するグループ IIAには全く活性が認められないことを見出している。興味深いことに、この違いは基質の選択性とも一致しており、前二者がホスファチジルコリンをよく分解できる(すなわちLPC産生能が高い)のに対し、後二者はホスファチジルコリン分解能が低いことが分かっている。これは上述した、sPLA2の神経栄養因子作用がLPC産生を介したものであるとの我々の仮説の有力な根拠の一つである。こうした理由から、神経系におけるグループVおよびX sPLA2の発現分布(発現時期、部位、産生細胞など)を明らかにするのが重要であると考えており、検討を進めている。最近、都臨床研の村上誠博士らはグループX sPLA2が一部の神経線維に発現することを明らかにしており(図6)、sPLA2が神経系で生理機能を果たすという我々の仮説に重要な示唆が与えられた。
図5 ほ乳類sPLA2
ほ乳類ゲノム中に見出されたsPLA2。左端は各グループの名称、右端は全長のアミノ酸数。各グループに共通してカルシウム結合配列と触媒部位が認められる。
図6 グループX sPLA2の神経線維における発現
抗グループX sPLA2抗体で神経系を染色すると、一部の神経線維が染色される(上2段:緑の矢印)。しかし他のグループのsPLA2(グループIIA, IID, V)に対する抗体ではこのような染色像は得られない(下段)。都臨床研・村上誠博士提供。
3. 神経系におけるLPCやSPCの動態の解析
LPCやSPCは血中にそれぞれ数百mM、数百nMの濃度で存在し、大部分リポタンパク質やアルブミンに結合した状態で存在することが知られている。しかし神経系組織中においてこれらのリゾリン脂質がどのような存在状態で、どの程度の量存在するのか全くわかっていない。組織中のこれらリゾリン脂質の量を定量的に把握し、グループVおよびX sPLA2やLPC・SPC受容体が発現する時期および部位と比較してLPCやSPCの生理的役割を考察することが重要であると考えている。
4. 微生物由来sPLA2の生理機能の解析
ほ乳類に比べ、微生物のsPLA2の生理機能に関する知見は乏しい。sPLA2は真核細胞のモデルである酵母には存在せず、糸状菌(かび)や原核生物であるが糸状菌様に生育する放線菌には見出されている(図7)。興味深いことに、ゲノム配列が明らかにされている麹菌Aspergillus oryzae、アカパンカビNeurospora crassa、イネいもち病菌Magnaporthe grisea、放線菌Streptomyces coelocolor A3(2)からはいずれも2個ずつのsPLA2遺伝子が発見されており、それぞれの微生物において各sPLA2は独立した役割を果たしているものと予想される。我々は麹菌からspaA、spaB の2つのsPLA2遺伝子を単離し、これらの酵素的性質および生理的役割を解析している。また、この研究はトリュフ (Tuber borchii)やアカパンカビのsPLA2を研究しているイタリア・パルマ大のSimone Ottonello教授らとの共同研究であり、緊密な情報交換のもとに行っている。
図7 微生物由来(グループXIV)sPLA2