最先端・次世代研究開発支援プログラム
シロイヌナズナの一生 ~生育ステージ分け~
ナタネは種子から油がとれる主要な油糧作物です。油脂増産には大きく分けて、1:種子数を増やすこと、2:種子あたりの油含量をあげること、の二つのアプローチが考えられます。1に関しては、肥料や光などの量の異なる条件下で植物を栽培し、得られた植物の種子重量などを求めることによって調査することができます。2に関しては、様々な条件下で得られた種子を化学的に分析することによって調査することができます。
ここでは1の導入編として、ナタネと同じアブラナ科に属し、小さく生長の早いシロイヌナズナを用いて実験を行い、どのような条件で育てたときに多くの種子が得られるのかを調査しました。
植物の栽培には、シロイヌナズナの研究で汎用的に用いられている水耕液を使用しました。通常濃度の水耕液で24日間栽培後、5倍から1/1000倍の5段階の濃度に調整した水耕液へ移植しました。移植後、経時的に各枝の莢数をカウントし、植物の生長に伴う莢数の増加の特徴を調査しました。
シロイヌナズナの生長の流れ
全ての水耕液濃度条件で、最初にロゼット葉が展開し、次に数本の茎が生長しました。播種50日目を超えた頃に、再度ロゼット葉の展開と茎の生長が見られました(図1-1)。ただし、茎の本数は水耕液濃度条件を反映して変化していました(図1-2)。
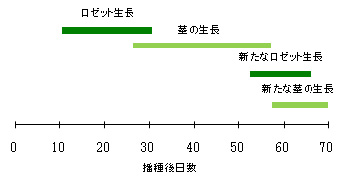

図1-1 1倍濃度で栽培した時の個体の生育段階
全ての濃度条件でほぼ同様の生育状況を示した
図1-2 異なる水耕液濃度下で栽培したシロイヌナズナ(播種後50日目)
茎単位では莢数を分枝で調整
茎は数本が順番に発生しますが、発生した順番が遅いほど、茎あたりの莢数は減少しました。そこで、茎における莢の着き方を詳しく調査しました。茎は大きく分けて、主茎と分枝から構成されます(図3)。同一水耕液濃度条件下で栽培した時は、主茎部分(図1-3 ○部分)に着く莢数が、どの茎でも、ほぼ等しくなっていました。つまり、発生の順番が遅いほど、分枝に着く莢数が減少していました。このことは、茎単位で見たときの莢数は、分枝で調整されていることを示しています。
水耕液濃度条件を変えて生育させると、植物個体の外観は、水耕液濃度条件ごとに大きく異なっていました。また、茎あたりで見た時の分枝に着いた莢数の割合は、大きく変化していました。これらのことは、植物が優先的に発達させる部位が、水耕液濃度で大きく影響されることを示しており、油脂収量を考える上で、興味深い結果でした。

図1-3 シロイヌナズナの茎のモデル図
まとめ
シロイヌナズナやナタネは抽台(花茎の抽出)以降、枯死するまで連続的に花を咲かせて莢を作り続けます。そのため、植物がどの生育段階にあるのかを判断することは、簡単ではありませんでした。
今回、シロイヌナズナがロゼットと茎の生長を順番に繰り返していることや、水耕液濃度条件ごとに主茎および分枝由来の莢数の割合が変化することがわかりました。このことは、シロイヌナズナが与えられた栄養を有効利用するために、バイオマスを小さくしたり養分の分配を調節した結果であると考えられます。
現在は、これらの植物に元素イメージングの手法(後述)を適用することにより、植物の生長の戦略についてさらに深い考察を進めています。
シロイヌナズナの生育に伴う元素の吸収
ナタネの油脂増産を目指し、ナタネと同じアブラナ科に属し、小さく生長の早いシロイヌナズナを用いて研究を行っています。これまでに、シロイヌナズナの水耕液の濃度そのもの、あるいは特定の元素の量を調整した環境下で植物を栽培し、生長の仕方を、茎の伸長や莢数のカウントによって調べてきました。
今回は、栽培中にサンプリングした水耕液の元素分析から、植物がどの時期にどのような栄養の吸収の仕方をするのかを調べました。
植物の栽培には、シロイヌナズナの研究で汎用的に用いられている水耕液を使用しました。通常濃度の水耕液で24日間栽培後、5倍から1/1000倍濃度に調整した水耕液に移植し、栽培しました。水交換の際に水耕液をサンプリングし、元素分析の手法により、植物による2日分の元素の吸収量を調査しました。
与えた量に対して植物が吸収した量の割合として元素の利用率を調査しました。すると、1/100、1/10、1および5倍条件の順に利用率は高くなっており(1/1000倍条件は検出感度以下)、低濃度下で栽培した植物ほど、与えられた養分を一生懸命吸収していることがわかりました(図1-4)。
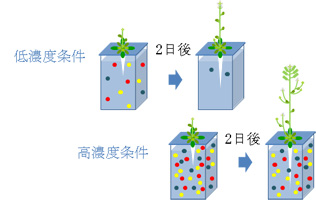
図1-4 低濃度条件と高濃度条件での栄養の利用のイメージ
低濃度条件では吸収量は小さいが、植物は与えられた栄養を貪欲に吸収する。
一方高濃度条件下では、吸収量は大きいものの、その利用率は小さい。
また、生育ステージによって各々の元素の必要量も異なる。
また、2日当たりの元素の吸収量について見てみると、濃度条件だけでなく、生育ステージによっても元素の吸収の仕方は異なっていました。すなわち、植物が元気に生長しているときはそのバイオマス量に比例して元素の吸収量も増加するのかというとそうではありませんでした。生長中にも関わらず、ある元素の吸収量が減少し、一方別の元素の吸収量が最大となるようなステージもあったのは興味深い点でした(図1-5)。
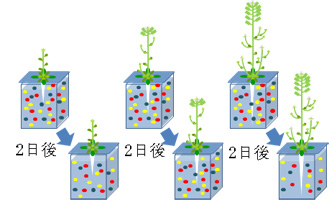
図1-5 生育段階ごとの栄養の吸収のイメージ
植物のバイオマスが増加する時期に必ずしも多くの栄養を吸収するわけではなかった。
このことは、植物がどの部位を育てているのか、各々の部位がどの成熟段階なのかによって必要な元素の種類や量が異なるためだと考えられます。ここでの検討だけでは、どの部位がどの元素をどれだけ必要としていたのかは、わかりませんでしたが、後述のイメージングの技術は、それらの知見を与えてくれると思われます(図1-6)。
生育ステージによって、必要な元素の量は異なることがわかりましたが、それでは要求量の少ないステージでは栄養をあまり与えなくても、与えた場合と同じように育つのでしょうか。また、必須元素を与えることが減収を導くような時期があるのでしょうか。なお、既往の研究によると、イネは出穂期にNやPを与えると収量減につながるとの報告があります。現在は、生育ステージによって栄養の与え方を変え、どの時期の施肥がより収量に貢献するのかを調べています。
図1-6 イメージング手法導入のイメージ
イメージング手法の導入により、元素がどの部位にどの程度吸収されるのかが明らかになる。
RRIS(Real-time radioisotope imaging system)
当研究室で開発しているReal-time Radioisotope Imaging System (RRIS)は、デジタルオートラジオグラフィ装置の一種です。植物試料に含まれる放射性同位体(以下RI)が放出する放射線をシンチレーターを用いて可視光に変換し、この光を超高感度カメラで撮像することで、植物試料に吸収されたRIの2次元分布を画像化します。当研究室ではミクロRRISとマクロRRISの2種類の装置を開発しており、ミクロRRISは光学顕微鏡レベル、マクロRRISは数mmから数十cmのRI分布を可視化する装置です。
ミクロRRIS
従来のミクロRRIS(図2-1)は光学像・蛍光像・RI分布像の3モードで画像を取得し、スーパーインポーズ(重ね合わせ)することが可能な装置として開発されました。しかし、多機能である反面、以下の問題がありました。
問題点1:
2種類の光学系を用いるため、スーパーインポーズの際に恣意性が入り、高倍率観察時のRI分布像の位置精度が劣る。
問題点2:
シンチレーターを植物体に密着させるための調整に時間がかかるため、RI添加直後の短時間に起こる現象を観察することが難しい。
問題点3:
RI分布像の拡大にテーパーFOPを使用していることから、収差が少ない一方で拡大率に限界がある。
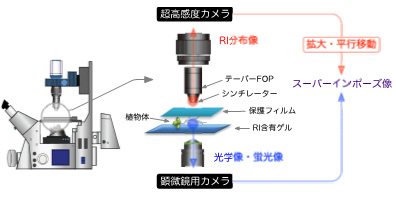
図2-1 従来のミクロRRIS
そこで本年度は、よりシンプルな光路を持ち、撮像前の調整が容易な装置を開発しました(図2-2)。これにより、以下のような改善効果が得られました。
改善点1:
RI分布像と光学像の取得を同一光路に統合したことで、恣意性の無いスーパーインポーズが可能になった。また、RI像の取得にテーパーFOP(x5)よりも高倍率の対物レンズ(x20)が利用できるようになった。
改善点2:
シンチレータープレートの自重によって試料とシンチレーターが密着するため、従来必要であった微調整が不要になり、RI添加から1分以内に観察を開始できるようになった。
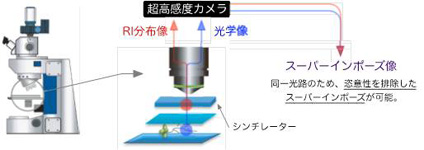
図2-2 改良型ミクロRRIS
図2-3はシロイヌナズナ根端で吸収された32P標識リン酸の分布を解析した際の像です。光学像(グレースケール)にRI分布像(疑似カラー)をスーパーインポーズしてあります。このように、改良型ミクロRRISを用いることで、シロイヌナズナの根端数百μmという微小な領域における様々な元素の吸収動態を可視化することが可能になりました。
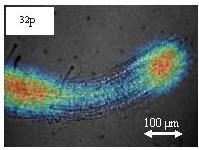
図2-3 改良型ミクロRRISで撮像したシロイヌナズナ根端におけるRI分布
マクロRRIS
RRISの開発・改良における技術的課題の一つに、遮光と照明の両立があります。放射線から変換された光はとても弱いため、高感度カメラ周辺は完全に遮光されている必要があります。その一方で、植物の生存には強い照明が必要であり、当研究室ではこれら2つの相反する条件を同時に満たす方法を検討・改良してきました。そこで、今回は遮光と照明に関する改良の歴史を紹介します。
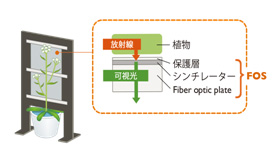
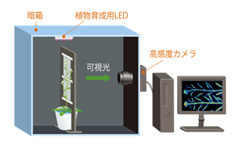
図2-4 マクロRRIS概要図
第1世代RRIS
遮光と照明を両立できず、暗条件のため、植物の生育ができず、短時間のみの実験しかできなかった。

図2-5 第1世代RRIS概要図
第2世代RRIS
暗箱の中にさらに植物育成用のチャンバーを設置し、このチャンバー内のみを照明することにより、植物の育成に照明を使うことができるようになった。ただし、遮光に50μm厚のアルミ板をつかっているため、透過性の高い放射線を出す同位体(32P・109Cd・137Csなど)しか検出できなかった。
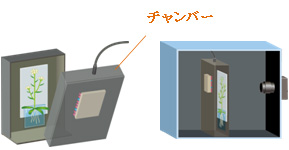
図2-6 第2世代RRIS概要図
第3世代RRIS
コンピューター制御により、高感度カメラの撮影中は照明Off、撮影していない時は照明Onに自動制御。 遮光板が不要なため、弱い放射線しか出さない放射性同位体(14C・35S・45Caなど)も検出できるようになった。
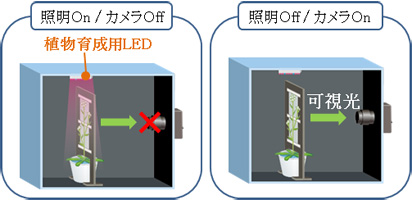
図2-7 第3世代RRIS概要図
スーパーインポーズ(RRIS + デジタルカメラ)
RRISでは、植物が吸収した元素(アイソトープ)をシンチレータで可視光に変え、その可視光を高感度カメラで撮影することにより、植物を破壊せずに吸収した元素をリアルタイムに見ることができます。本研究室ではこのRRISの開発、改良、および吸収する元素のタイミングや量などの研究を行っています。
これまでのRRISの課題として、必ずしも吸収した元素が植物全体に輸送するわけではなく、また撮影中にも植物が生長していくため、その元素が植物体のどの位置にあるのかを把握するのが難しいことがありました。

図2-8 RRIS画像のイメージ図
そこで、上記で紹介した、照明のOn/Offに合わせ、照明がOnの間(高感度カメラがOff時)にデジタルカメラによる植物の実画像を取得し、RRISによる画像とデジカメ画像を重ね合わせるスーパーインポーズを開発いたしました。このシステムにより、植物の生長に合わせて、元素の吸収、輸送を映像化することができるようになりました(図15)。
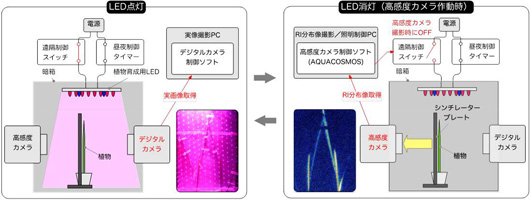
図2-9 RRISシステム概要図
図2-10は、シロイヌナズナにルビジウム(86Rb)を吸収させた連続写真です。このように、吸収した元素が植物のどの位置まで輸送されたか、視覚的にわかるようになりました。

図2-10 86RbのRRIS画像
研究成果紹介リーフレット
このページの内容をまとめたリーフレットを作成し、サイエンスカフェ等の機会に配布しております。下記のリンクからPDFファイルもダウンロード可能です。
- 研究成果紹介リーフレット2011年号(2.9MB)
- 研究成果紹介リーフレット2012年号(6.8MB)