野崎研究室 研究内容
野崎研究室では、
- 有機化学の研究をおこなっています。
- 触媒反応を中心に、有機合成・高分子合成のための方法論を開発しています。同時に、独自の手法で得られる新物質についてもその機能を追求します。
- その研究は美しいか? その研究は本当に社会に役立つ可能性があるのか? など、多角的な視点から「本当におもしろいこと」を追求します。研究対象の広さと、メンバーの多才さが自慢です。
以下に、最近の個々のテーマの説明を述べる。
1-1. 二酸化炭素を原料とする物質合成
二酸化炭素は安価で豊富な炭素資源であり、魅力的なC1資源である。当研究室では二酸化炭素を原料として用いるポリマー合成や汎用化学品合成に取り組んでいる。
1-1-1. 二酸化炭素を原料とするポリマー合成
二酸化炭素は炭素の再安定状態であり、他の物質に変換するためには外部よりエネルギーを与える必要がある。ポリマー合成では、反応性の高いモノマーと共重合を行うことでエネルギーを与え、二酸化炭素をポリマーに変換することができる。
当研究室では、合成ゴムの原料であるブタジエンと二酸化炭素から合成されるラクトン(EVP)を用いて単独重合や共重合を行うことで、二酸化炭素とアルケンを原料とする種々のポリマーの合成に成功している。EVPの単独重合(ラジカル重合)により、質量の29%が二酸化炭素由来であるという高い二酸化炭素含有率のポリマーの合成を達成した(1)。得られたポリマーは高いガラス転移点・分解点など物性面でも、既存の二酸化炭素を原料とするポリマーとは異なった特徴を持つ。また、このポリマーは水またはアミンの存在下で可逆的に構造が変化することを見出した(2)。この結果はEVPのポリマーの物性が可逆的に制御できることを示している。
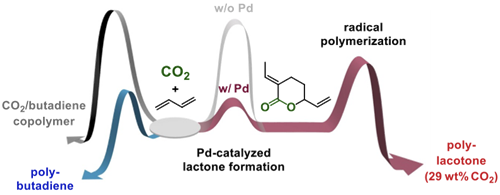
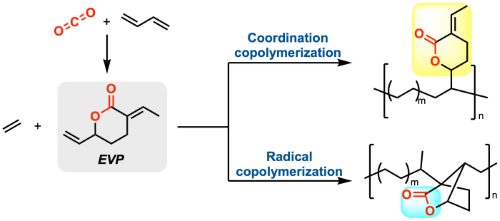
EVPと他のオレフィンの共重合についても検討を行っている。EVPとエチレンについては、Pd触媒による配位重合とラジカル重合のそれぞれで重合を達成している(3)。配位重合の場合はラクトンを側鎖に持つポリマーが得られたのに対し、ラジカル重合の場合はラクトンを主鎖に持つポリマーが得られ、重合形式によって構造を変化させられることを見出した。その他、アクリル酸メチル、スチレン、酢酸ビニルなどの汎用モノマーとのラジカル共重合によりポリマーの物性を変化させることができることを報告している(4)。
最近の発表論文
(1) Nakano, R.; Ito, S.; Nozaki, K. Nat. Chem. 2014, 6, 325–331. 10.1038/nchem.1882
(2) Moon, S.; Masada, K.; Nozaki, K. J. Am. Chem. Soc. 2019, 141, 10938–10942. 10.1021/jacs.9b03205
(3) Tang, S.; Zhao, Y.; Nozaki, K. J. Am. Chem. Soc. 2021, 143, 17953–17957. 10.1021/jacs.1c08578
(4) Hill, M.; Tang, S.; Masada, K.; Hirooka, Y.; Nozaki, K. Macromolecules 2022, 55, 3311–3316. 10.1021/acs.macromol.1c02503
1-1-2. 二酸化炭素を原料とする汎用化学品合成
ギ酸は繊維の染色助剤や牧草の貯蔵用添加剤などとして世界で年間70万トン以上生産される重要な工業原料であり、現在工業的には一酸化炭素と水の反応により合成されている。当研究室では、PNPイリジウムトリヒドリド錯体を二酸化炭素の水素化触媒に用い、触媒回転頻度150,000毎時(発表当時世界最高)、触媒回転数は3,500,000(今なお世界最高)を達成した。また、有機塩基を利用した高活性なギ酸合成にも展開している(1,2)。
その他、銅錯体を用いたアルデヒドと二酸化炭素からのα-ヒドロキシ酸合成など、二酸化炭素を還元により様々な有用化合物へ変換する手法の開発を進めている(3)。
最近の発表論文
(1) Aoki, W.; Wattanabinin, N.; Kusumoto, S.; Nozaki, K. Bull. Chem. Soc. Jpn. 2016, 89, 113–124. 10.1246/bcsj.20150311
(2) Takaoka, S.; Eizawa, A.; Kusumoto, S.; Nakajima, K.; Nishibayashi, Y.; Nozaki, K. Organometallics 2018, 37, 3001–3009. 10.1021/acs.organomet.8b00377
(3) Masada, K.; Kusumoto, S.; Nozaki, K. Org. Lett. 2020, 22, 4922–4926. 10.1021/acs.orglett.0c00995
1-2. 一酸化炭素を利用する物質合成
ヒドロホルミル化反応は、アルケンと水素・一酸化炭素から一炭素増炭したアルデヒドを得る反応であり、工業的に最も重要な均一系触媒反応のひとつである。当研究室では、より高い触媒活性および高い位置選択性を与えるヒドロホルミル化反応の開発を目指し、新規遷移金属触媒の探索を行っている。
ヒドロホルミル化反応には通常ロジウムやコバルトなどの9族金属が用いられるが、当研究室では、8族金属であるルテニウムを中心金属として持つ新規触媒を開発した。ルテニウム錯体を嵩高いリン酸エステル配位子と組み合わせることにより、1-アルケンの直鎖選択的ヒドロホルミル化反応を達成した(1)。また、ロジウムと3座配位子であるN-Triphosの組み合わせにより、1-アルケンの枝分かれ選択的ヒドロホルミル化反応の開発にも成功した(2)。
また、これまで着目されてこなかった逆反応「レトロヒドロホルミル化反応」も達成した(3)。
アルコールは、ヒドロホルミル化反応および引き続く水素化反応の2段階で工業的に生産されている。当研究室ではロジウム触媒によるヒドロホルミル化反応とルテニウム触媒による水素化反応を組み合わせることで、アルケンからアルコールをワンポット高効率で合成することにも成功した(4-6)。石油化学プロセスの高効率化への貢献が期待される。現在は不均一系触媒と組み合わせながら更なる高活性化を目指している。
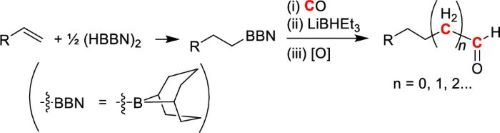
また近年、アルケンとヒドロボランから得られるアルキルボランを一酸化炭素・ヒドリドと混合させると重金属フリーな条件下、複数増炭したアルデヒド類が得られることを見出した(7)。
最近の発表論文
(1) Takahashi, K.; Yamashita, M.; Tanaka, Y.; Nozaki, K. Angew. Chem. Int. Ed. 2012, 51, 4283–4387. 10.1002/anie.201108396
(2) Phanopoulos, A.; Nozaki, K. ACS Catal. 2018, 8, 5799–5809. 10.1021/acscatal.8b00566
(3) Kusumoto, S.; Tatsuki, T.; Nozaki, K. Angew. Chem. Int. Ed. 2015, 54, 8458–8461. 10.1002/anie.201503620
(4) Takahashi, K.; Yamashita, M.; Ichihara, T.; Nakano, K.; Nozaki, K. Angew. Chem. Int. Ed. 2010, 49, 4488–4490. 10.1002/anie.201001327
(5) Takahashi, K.; Yamashita, M.; Nozaki, K. J. Am. Chem. Soc. 2012, 134, 18746–18757. 10.1021/ja307998h
(6) Yuki, Y.; Takahashi, K.; Tanaka, Y.; Nozaki, K. J. Am. Chem. Soc. 2013, 135, 17393–17400. 10.1021/ja407523j
(7) Phanopoulos, A.; Pal, S.; Kawakami, T.; Nozaki, K. J. Am. Chem. Soc. 2020, 142, 14064–14068. 10.1021/jacs.0c06580
1-3. 金属–配位子協働作用を用いた結合切断/形成反応
遷移金属中心上での酸化的付加/還元的脱離による結合の切断/形成反応に対して、金属と配位子が同時に結合切断/形成に関与する「金属配位子協働作用」が近年注目を集めている。この作用により、金属のみでは不可能であった特異な反応性および選択性を引き出すことができる。当研究室では、酸化還元活性なシクロペンタジエノン–ヒドロキシシクロペンタジエニル配位子を持つ錯体の金属–配位子協働作用による結合切断/形成に着目し研究を行っている。シクロペンタジエニル配位子を有するイリジウム/ロジウムヒドリド錯体を用いることで、C–C単結合の酸化剤を用いない飽和炭化水素類の触媒的脱水素化反応(1,2)、C–O結合の加水素分解反応(3)、アミンボランの脱水素反応(4)を開発した。有機合成や創薬化学、バイオマス利用などへの応用が期待される。実際に開発した触媒がリグニンモデル化合物中のC–O結合やC–C結合の切断反応に利用できることを見出した(5)。現在、樹脂分解への応用を試みている。
上記の反応は主にH–H結合切断/形成を鍵としていたが、近年金属–配位子協働作用による様々な結合の切断/形成反応の開発が進められている(6)。本研究室ではヒドロキシシクロペンタジエニルメチル白金(IV)錯体におけるC–H結合不均等還元的脱離反応を報告した(7)。本反応は、これまでにない機構によるC–H結合還元的脱離を提示するものであった。その後計算化学により設計した電子不足シクロペンタジエノン配位子を持つイリジウム錯体を用いることで、上記反応の逆反応であるC–H結合不均等酸化的付加反応が進行することを明らかにした。本反応においてメタンのC–H結合も切断されたことから、今後更なる単純炭化水素の有効活用への応用が期待される(8)。
更に新規シクロペンタジエノンイリジウム(I)錯体は、ヒドロボラン・ヒドロシラン中のB–H/Si–H結合を配位子上のH+と金属上のB–/Si–へ切断する極性転換を進行させることがわかった(9,10)。また錯体とPh3SiHの反応後得られるヒドロキシシクロペンタジエニルイリジウムシリル錯体は、続く分子内加プロトン分解によりベンゼンを放出しながらシクロペンタジエノンイリジウムシリレン錯体を与える(10)。
最近の発表論文
(1) Kusumoto, S.; Akiyama, M.; Nozaki, K. J. Am. Chem. Soc. 2013, 135, 18726–18729. 10.1021/ja409672w
(2) Ando, H.; Kusumoto, S.; Wu, W.; Nozaki, K. Organometallics 2017, 36, 2317–2322. 10.1021/acs.organomet.7b00245
(3) Kusumoto, S; Nozaki, K. Nat. Commun. 2015, 6, 6296. 10.1038/ncomms7296
(4) Pal, S.; Kusumoto, S.; Nozaki, K. Organometallics 2018, 37, 906–914. 10.1021/acs.organomet.7b00889
(5) Kusumoto, S.; Kishino, M.; Nozaki, K. Chem. Lett. 2020, 49, 477–480. 10.1246/cl.200037
(6) Higashi, T.; Kusumoto, S.; Nozaki, K. Chem. Rev. 2019, 119, 10393–10402. 10.1021/acs.chemrev.9b00262
(7) Higashi, T.; Ando, H.; Kusumoto, S.; Nozaki, K. J. Am. Chem. Soc. 2019, 141, 2247–2250. 10.1021/jacs.8b13829
(8) Higashi, T.; Kusumoto, S.; Nozaki, K. J. Am. Chem. Soc. 2021, 143, 12999–13004. 10.1021/jacs.1c06714
(9) Higashi, T.; Kusumoto, S.; Nozaki, K. Angew. Chem. Int. Ed. 2021, 60, 2844–2848. 10.1002/anie.202011322
(10) Higashi, T.; Kusumoto, S.; Nozaki, K. Organometallics 2022, 41, 659–665. 10.1021/acs.organomet.2c00037
2-1. 新規高機能ポリマーの合成
疎水性の炭化水素であるポリオレフィンに極性官能基を導入することで、接着性、着色性、染色性などの親水性の機能が向上し、用途が飛躍的に広がると期待される。そのための最も有効な手段のひとつがオレフィンと極性モノマーの共重合である。我々はこれまでに、ホスフィン-スルホナート配位子をもつパラジウム触媒を用いることでエチレンと各種極性モノマーの配位共重合を達成しており(1)、最近では触媒の実用化に向けて、さらなる触媒活性および分子量の向上に取り組んでいる。ホスフィン-スルホナート配位子の置換基の立体効果を系統的に調べることで、従来の触媒系より劇的に高い分子量のポリマーを合成することに成功した(2)。また機械学習を触媒の設計に取り入れることで、エチレン/アクリル酸メチル共重合に高い活性を示すホスフィン-スルホナートパラジウム錯体の創出を達成している(3)。
さらに、非対称な電子供与性部位をもつ二座配位子がエチレンと極性ビニルモノマーの配位共重合に適していると考え、新規共重合触媒としてビスホスフィンモノオキシド(BPMO)配位子(4,5)やイミダゾ[1,5-a]キノリン-9-オラート-1-イリデン(IzQO)配位子(6)に代表される含窒素複素環カルベン(NHC)を含む二座配位子(7-10)を有するパラジウム触媒の開発にも成功している。加えて、高価なパラジウムの代替として比較的安価なニッケルを触媒に用いた共重合も達成している(11-15)。
上述の二座配位子を有するパラジウム錯体を用いることで、エチレンと1,1-二置換エチレンやカルベンなど様々な極性モノマーとの共重合を世界で初めて達成した(16-18)。
エチレン/極性モノマー共重合よりも高難度なプロピレン/極性モノマー共重合を、IzQO配位子を用いて実現した(6)。さらに、キラルなメンチル基をリン上に有するパラジウム触媒(19)やニッケル触媒(13)によって中程度に立体選択的な共重合体を合成した。近年では、ホスフィン配位子のリン上にサイズの異なる二つの置換基を導入したP-キラルなホスフィン-スルホナート配位子やBPMO配位子を持つパラジウム触媒を用いることで、非常に高いイソタクチック選択性を持つ共重合体が得られるということを発見した(20)。
最近の発表論文
(1) Ito, S.; Kanazawa, M.; Munakata, K.; Kuroda, J.; Okumura, Y.; Nozaki, K. J. Am. Chem. Soc. 2011, 133, 1232–1235. 10.1021/ja1092216
(2) Ota, Y.; Ito, S.; Kuroda, J.; Okumura, Y.; Nozaki, K. J. Am. Chem. Soc. 2014, 136, 11898–11901. 10.1021/ja505558e
(3) Akita, S.; Guo, J -Y.; Seidel, F.; Sigman, M.; Nozaki, K. Organometallics 2022, in press. 10.1021/acs.organomet.2c00066
(4) Mitsushige, Y.; Carrow, B. P.; Ito, S.; Nozaki, K. Chem. Sci. 2016, 7, 737–744. 10.1039/C5SC03361F
(5) Mitsushige, Y.; Yasuda, H.; Carrow, B.; Ito, S.; Kobayashi, M.; Tayano, T.; Watanabe, Y.; Okuno, Y.; Hayashi, S.; Kuroda, J.; Okumura, Y.; Nozaki, K. ACS Macro Lett. 2018, 7, 305–311. 10.1021/acsmacrolett.8b00034
(6) Nakano, R.; Nozaki, K. J. Am. Chem. Soc. 2015, 137, 10934–10937. 10.1021/jacs.5b06948
(7) Tao, W.; Akita, S.; Nakano, R.; Ito, S.; Hoshimoto, Y.; Ogoshi, S.; Nozaki, K. Chem. Commun. 2017, 53, 2630–2633. 10.1039/C7CC00002B
(8) Akita, S.; Nakano, R.; Ito, S.; Nozaki, K. Organometallics 2018, 37, 2286–2296. 10.1021/acs.organomet.8b00263
(9) Tao, W.; Wang, X.; Ito, S.; Nozaki, K. J. Polym. Sci. Part A: Polym. Chem. 2019, 57, 474–477. 10.1002/pola.29270
(10) Akita, S.; Nozaki, K. Polym. J. 2021, 53, 1057–1060. 10.1038/s41428-021-00500-3
(11) Ito, S.; Ota, Y.; Nozaki, K.; Dalton Trans. 2012, 41, 13807–13809. 10.1039/C2DT31771K
(12)Tao, W.; Nakano, R.; Ito, S.; Nozaki, K. Angew. Chem. Int. Ed. 2016, 55, 7505–7509. 10.1002/anie.201600819
(13) Konishi, Y.; Tao, W.; Yasuda, H.; Ito, S.; Oishi, Y.; Ohtaki, H.; Tanna, A.; Tayano, T.; Nozaki, K. ACS Macro Lett. 2018, 7, 213–217. 10.1021/acsmacrolett.7b00904
(14) Jung, J.; Yasuda, H.; Nozaki, K. Macromolecules 2020, 53, 2547–2556. 10.1021/acs.macromol.0c00183
(15) Seidel, F. W.; Nozaki, K. Angew. Chem. Int. Ed. 2022, 62, e202111691. 10.1002/anie.202111691
(16) Wang, X.; Seidel, F. W.; Nozaki, K. Angew. Chem. Int. Ed. 2019, 58, 12955–12959. 10.1002/anie.201906990
(17) Wang, X.; Nozaki, K. J. Am. Chem. Soc. 2018, 140, 15635–15640. 10.1021/jacs.8b10335
(18) Yasuda, H.; Nakano, R.; Ito, S.; Nozaki, K. J. Am. Chem. Soc. 2018, 140, 1876–1883. 10.1021/jacs.7b12593
(19) Ota, Y.; Ito, S.; Kobayashi, M.; Kitade, S.; Sakata, K.; Tayano, T.; Nozaki, K. Angew. Chem. Int. Ed. 2016, 55, 7505–7509. 10.1002/anie.201600819
(20) Seidel, F. W.; Tomizawa, I.; Nozaki, K. Angew. Chem. Int. Ed. 2020, 59, 22591–22601. 10.1002/anie.202009027
2-2. ポリマーの分解

当研究室は廃棄されたプラスチックが環境に与える負荷にも焦点を当て、分解可能なプラスチックの開発に取り組んでいる。近年では一酸化炭素源に金属カルボニルを用いることで、一酸化炭素がランダムにポリエチレン鎖内に取り込まれたポリマーの合成に成功し、得られたポリマーはUVの照射により部分的に分解されることを見出した(1)。現在、プラスチックを分子レベルに分解するための触媒開発を行っている。
最近の発表論文
(1) Tang, S.; Seidel, F. W.; Nozaki, K. Angew. Chem. Int. Ed. 2021, 60, 26506–26510. 10.1002/anie.202110957
電子状態が精密に制御された「美しい分子」は、今までになかった機能を発現する。本章では、最近我々が合成した「美しい分子」を紹介する。
3-1. ヘテロベンゼンを含む新規配位子の合成
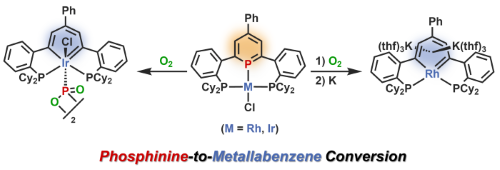
ベンゼンの1つのC–H部分をリン原子に置換した化合物であるホスフィニン(ホスファベンゼン)は、強い電子求引性やリン原子の反応性など、興味深い性質を持つ。当研究室では新たに、中心にホスフィニンを、左右に2つのホスフィン部位を持つ三座配位子を合成した(1)。合成したイリジウム錯体やロジウム錯体の反応性を検討した結果、酸素との反応によりホスフィニン上のリン原子と金属部分が入れ替わり、メタラベンゼンを与えることが分かった。特にロダベンゼンについては初の合成例である。
最近の発表論文
(1) Masada, K.; Kusumoto, S.; Nozaki, K. Angew. Chem. Int. Ed. 2022, 61, e202117096. 10.1002/anie.202117096
3-2. トリプチセン骨格分子の合成
トリプチセンは、三つのベンゼン環が120°で縮環した化合物であり、剛直に保持された三回回転対称性に由来する特異的な物性を示す。近年我々は、トリプチセンの三つのベンゼン環をベンゾキノンに置換した(BQ)3とヒドロキノンに置換した(HQ)3の均化反応により、トリプチセンが1つのヒドロキノンと2つのベンゾキノンに置換された(HQ)1(BQ)2を合成した。(HQ)1(BQ)2は、結晶中では水素結合ネットワークを示す一方、溶液中では不均化反応を示すことも見出した(1)。
最近の発表論文
(1) Takemasa, Y.; Nozaki, K. J. Org. Chem. 2022, 87, 1502–1506. 10.1021/acs.joc.1c01683
3-3. ヘリセン類縁体の合成
ヘリセンは、複数の芳香環がらせん状にオルト縮環した分子群であり、共役面の非平面性やらせん不斉など、ねじれた構造に起因する特異な性質を示す。我々はこれまでに、中央に窒素、酸素、リン、ケイ素などの種々のヘテロ原子を含む五員環を有するヘリセン類縁体を合成し、導入するヘテロ原子の種類によって異なる性質を示すことを明らかにしてきた(1-4)。近年我々はケイ素原子を中心に、二分子のヘリセンをらせん軸が直交する形で連結したスピロダブルシラ[7]ヘリセンを合成した(5)。この分子は、LUMOにおいて、スピロ原子を介した非局在化(スピロ共役)によって安定化を受ける。現在は更に、中心元素として遷移金属を取り入れたヘリセン類の合成に挑戦している(6)。
最近の発表論文
(1) Nakano, K.; Hidehira, Y.; Takahashi, K.; Hiyama, T.; Nozaki, K. Angew. Chem. Int. Ed. 2005, 44, 7136–7138. 10.1002/anie.200502855
(2) Nakano, K.; Oyama, H.; Nishimura, Y.; Nakasako, S.; Nozaki, K. Angew. Chem. Int. Ed. 2012, 51, 695–699. 10.1002/anie.201106157
(3) Oyama, H.; Nakano, K.; Harada, R.; Kuroda, R; Naito, M.; Nobusawa, K.; Nozaki, K. Org. Lett. 2013, 15, 2104–2107. 10.1021/ol4005036
(4) Oyama, H.; Akiyama, M.; Nakano, K.; Naito, M.; Nobusawa, K.; Nozaki, K. Org. Lett. 2016, 18, 3654–3657. 10.1021/acs.orglett.6b01708
(5) Terada, N.; Uematsu, K.; Higuchi, R.; Tokimaru, Y.; Sato, Y.; Nakano, K.; Nozaki, K. Chem. Eur. J. 2021, 27, 9342–9349. 10.1002/chem.202100385
(6) Iwasaki, T.; Hirooka, Y.; Takaya, H.; Honma, T.; Nozaki, K. Organometallics 2021, 40, 2489–2495. 10.1021/acs.organomet.1c00248
3-4. 有機典型元素化学・構造有機化学
低原子価典型元素化合物は特異な電子状態、およびそれに起因する特徴的な構造や反応性に興味が持たれる。現在当研究室では炭素の2価化学種である「カルベン(1)」および0価化学種「カルボン(2)」に着目し、構造有機化学・配位化学的観点から研究を行っている。今後は炭素以外の元素にも対象を拡大し、典型元素の未知の性質の解明を目指す。
最近の論文発表
(1) Shibutani, Y.; Kusumoto, S.; Nozaki, K. J. Am. Chem. Soc. 2023, 145, 16186–16192.
(2) Saito, K.; Kusumoto, S.; Nozaki, K. Chem. Eur. J. 2023, e202302060.
不均一系触媒は、反応溶媒に自身が溶解する均一系触媒と比較して、回収・再利用が容易であり、石油化学産業において基礎化学品合成に多く実用化されている。しかし、活性点の構造を精密に制御することが難しいため、厳密な反応制御を必要とする精密有機合成分野では未だ原子・分子レベルで設計可能な均一系触媒が多く用いられている。我々は均一系および不均一系触媒の利点を持ち合わせた「均一系の正確さで機構を論じる不均一系触媒」を創出し、挑戦的な有機合成反応の新規不均一系触媒を開発することを目指す。
4-1. フェノール類の芳香族炭化水素への選択的加水素分解
フェノール類の芳香族炭化水素への選択的加水素分解は、バイオマス変換やファインケミカル合成において重要な反応である。当研究室では、従来の触媒系より低温・低圧の温和な条件下で、幅広いフェノール類を選択的に芳香族炭化水素に変換する、メタリン酸アルミニウム (Al(PO3)3) を担体とした白金ナノ粒子触媒を開発した(1)。反応機構の検討により、担体と白金ナノ粒子が協働的に働くことが、選択的加水素分解の鍵であることが示唆された。
最近の論文発表
(1) Jin, X.; Tsukimura, R.; Aihara, T.; Miura, H.; Shishido, T.; Nozaki, K. Nat. Catal. 2021, 4, 312–321. 10.1038/s41929-021-00598-x