




リアルタイムRIイメージングシステム
1. はじめに
植物の生育には17の元素が必要とされている。植物はこれらの元素を選択的に吸収し代謝し生長している。そのため、私たちは施肥という形でこれらの元素を土壌中に補い、農作物の生育を向上させてきた。しかし、施肥は経験則から行われていることが多く、植物によるミネラル吸収が植物自身によってどのようにコントロールされているのか、そのメカニズムの全貌は未解明である。植物の生育と栄養元素の関係を詳細に調べることができれば、より効果的に施肥を行い植物の潜在的な生長能力をひきだすことができるのではないかと考えている。
植物生理学の研究分野において、栄養元素はその欠乏や過剰による障害応答を中心に調べられてきた。近年では、分子生物学、膜の生物物理学による解析が進められ個々の栄養元素の獲得や輸送の分子機構が分かってきている。また、大規模な遺伝子の発現解析により栄養障害時に働く遺伝子が多数同定されてきている。しかし、植物が何をもって過不足を判断するのか?という応答の最も基本の情報については研究の途上にあり、この解明のためには、元素の移動や蓄積を詳細に理解する必要がある。 そのような中で、私たちは栄養元素そのものに注目し、植物による吸収および体内での輸送機構の解析を進めてきた。
2. イメージングシステムの開発と改良
放射性同位体元素が研究に用いられるまで、植物生理学者は植物組織内の無機イオンの流動を感度良く定量的に測定することができなかった。1950年代頃始め頃から放射性同位体元素が利用されるようになり、植物の無機栄養の研究に新たな知見が得られるようになった。カリウムは、植物細胞内に存在するカチオンの中で最も含量が多い元素であるが、カリウムの同位体である42Kと同族体の86Rbをトレーサとした実験により、カリウムイオンの吸収輸送が外環境のイオン濃度に依存することが明らかにされている。放射性同位体元素で標識した無機イオンの追跡は、吸収、転流、流出を調べる唯一の方法であり、現在でも古典的な実験手法として残っている。
しかし、これらの実験でひとつ難点なのが、トレーサの測定のために植物を切断する、X線フィルムやImaging Plate(Fuji film)に固定するといった破壊的実験であるということである。同一の個体を追跡して解析することはもちろん、複数の個体を用いたとしても経時変化を解析するのは容易ではなかった。しかし、生きた植物体内の状況が刻々と変化していることを考えると、植物の生理活性を保ったままにトレーサの追跡ができることが理想的である。本研究室では、「生きた植物体内の放射性トレーサをイメージングする」ということを目標とし、新たな機器の開発に取り組んできた。
放射性同位体の検出は、大きく分けて放射線そのものを検出する手法とシンチレーション反応により放射線を光に変えて検出する手法がある。当研究室のシステムは、後者の原理を応用したものである。近年、光の検出は一フォトンの検出も可能なほどに技術革新が進んでいることから、微弱光検出のための高感度カメラの利用により放射性の高感度な検出が期待された。システムの仕組みは、植物サンプルを板状のシンチレータ(CsI-Tl)に接触させ、植物体内から発せられる放射線を光に変換して、MCPを搭載したカメラで検出するというものである(図1)。

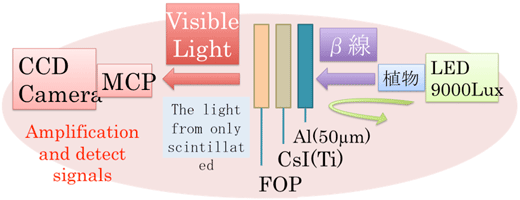
図1 左:イメージングシステム外観 右:イメージングシステムの原理
このシステムを汎用性の高いImaging plateとの比較で評価したところ、分解能は同等でありながら約20倍の感度が確保されていた。そのため、一枚の画像を最短2分間の積算で撮影することに成功し、連続して撮影した画像を最終的に繋げてダイナミックなイメージ画像を作成した1),2)。現在、このシステムでは、リン(32P)、硫黄(35S)、カルシウム(45Ca)、炭素(14C)、Cd(109Cd)3)の観察が可能である。
システムの立ち上げ当初は、5cm×5cmのシンチレータ版を用いて、植物の葉、種子など器官限定的に撮影を試みていたが、シンチレータ板の面積の拡大と植物設置方法の改良により植物体個体全体を同時に観察できるまでになっている。また、高感度カメラの特性上から暗箱内での撮影が必須であったが、植物設置部位のみに光が照射されるように暗箱内に箱を設置して植物の生理活性を保つことにした(図2)4)。
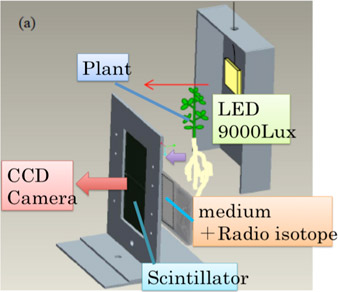
図2 植物サンプルに光を照射する仕組み
3. 植物生理学(低リン酸環境下における植物の応答解析)への応用
当研究室では植物の栄養元素のうち多量必須元素に分類されているリンに注目して、研究を進めている。リン(32P)のイメージング解析からまず始めに見えてくるのは、植物体内のリン輸送が各器官の新旧によりコントロールされていることである。ダイズの葉の例を見てみると、最も若い葉と古い葉では、圧倒的に若い発達中の葉と新芽の移行蓄積が高いことが分かる(図3)。また、一枚の葉内でも葉脈ごとに分布の偏りが見られるなど、植物体内の輸送の制御が細胞レベルで生じていることが考えられた。
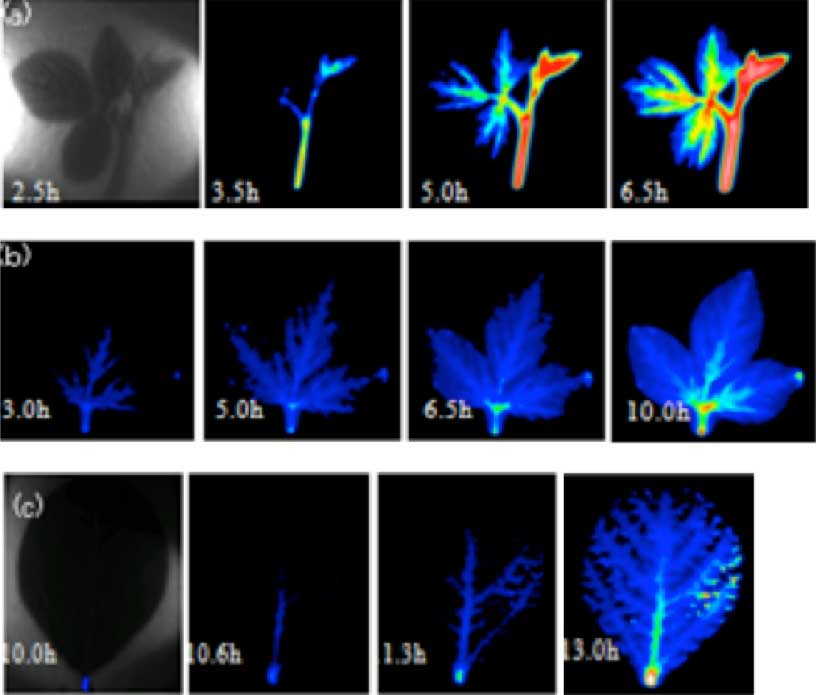
図3 ラジオアイソトープイメージングシステムによるダイズ器官別の32P動態解析
次に、植物体個体全体を一度に撮影できるようになったことから、幼植物期~花芽期~種子形成期までの生育ステージが異なる差異の輸送をイメージングにより比較した。花芽や種子が形成される期間では、これらの組織に輸送されるリンが他の器官に比較して圧倒的に多いことが示された(図4)。

図4 ラジオアイソトープイメージングシステムによる植物個体全体の32P動態解析
(a)20日栽培後の植物体。全体に広がっていた。(b)花芽期は、幼植物期よりも葉への移行が減少していた。(c)種子形成期には、種子へすみやかに移行し蓄積されていた。画像中の円は32P 1,5,10,25kBqを示す。
過去のリン研究から、植物はリン欠乏環境下では、根の発達を促進すること、根の膜に存在して選択的にリンを取り込むタンパク質の種類や数を変えながらリンの取り込み能力を向上させていることが分かっている。しかし、実際の輸送基質であるリンの輸送についての報告はないため、栽培時のリン栄養条件を制限した場合の輸送変化をイメージングにより解析することも試みてきた。リン栄養を途中から与えずに栽培した場合、リンの吸収は潤沢なものに比べ約7倍ものリンを取り込み茎や葉へ輸送していたことや、画像から移行速度を算出するなど、イメージング解析という植物研究の新しい解析方法を提示してきている。
4. これから
植物個体全体のダイナミックな物質輸送の次に興味深いのは、細胞間や細胞内の無機イオンの動態である。当研究室では、上記に示した検出システムを顕微鏡に応用したイメージングにも挑戦してきた5)。現在、さらなる分解能の向上にむけて改良を重ねているところである。将来は、蛍光標識したタンパク質の局在や遺伝子発現部位の観察と無機イオンの観察を同時に行い、植物の無機栄養応答機構の解明のためにこの技術を応用していきたいと考えている。
関連文献
- Kanno, S.; Rai, H.; Ohya, T.; Hayashi, Y.; Tanoi, K. and Nakanishi, T., “Real-time imaging of radioisotope labeled compounds in a living plant”, JOURNAL OF RADIOANALYTICAL AND NUCLEAR CHEMISTRY (2007) 272 565 - 570.
- Rai, H.; Kanno, S.; Hayashi, Y.; Ohya, T.; Nihei, N. and Nakanishi, T.M., “Development of a real-time autoradiography system to analyze the movement of the compounds labeled with beta-ray emitting nuclide in a living plant( 植物中の物質動態解析のためのβ崩壊核種を用いたリアルタイムオートラジオグラフィーシステムの開発 )”, RADIOISOTOPES (2008) 57 287 - 294.
- Yamawaki, M.; Hirose, A.; Kanno, S.; Ishibashi, H.; Noda, A.; Tanoi, K. and Nakanish, T.M., “Evaluation of Cd-109 Detection Performance of a Real-Time RI Imaging System for Plant Research( 植物の研究のためのリアルタイムRIイメージングシステムの109Cd検出性能評価 )”, RADIOISOTOPES (2010) 59 155 - 162.
- Yamawaki, M.; Kanno, S.; Ishibashi, H.; Noda, A.; Hirose, A.; Tanoi, K. and Nakanishi, T., “The development of real-time RI imaging system for plant under light environment”, JOURNAL OF RADIOANALYTICAL AND NUCLEAR CHEMISTRY (2009) 282 275 - 279.
- Rai, H.; Kanno, S.; Hayashi, Y.; Nihei, N. and Nakanishi, T.M., “Development of a fluorescent microscope combined with a real-time autoradiography system( リアルタイムオートラジオグラフィーシステムを搭載したラジオアイソトープ-蛍光顕微鏡の開発 )”, RADIOISOTOPES (2008) 57 355 - 360.
植物におけるマグネシウム吸収・移行解析
植物のMg栄養について
Mgは多量必須元素であり、植物細胞内でのイオン濃度はカリウムに次いで2番目に高い元素です。Mgは、300種類を超える酵素の活性維持に必須である他、RNAの高次構造形成や細胞の浸透圧調整にも重要な役割を果たします。植物においては、葉緑素の中心元素として光合成にも必須の元素です。
私たちは、植物がMg栄養の過不足にどのように応じて成長を維持するのかを、Mg欠乏応答機構、Mg吸収・輸送機構、およびMg輸送分子の解析を通じて理解したいと考えています。
Mg欠乏応答機構の解析
Mgが不足すると、葉が黄化やデンプンの過剰蓄積が生じます。通常、これらのMg欠乏症状の発症は、Mgを培地から除いてから1週間以上経過すると見られるようになります。また、Mg欠乏症は、生育の旺盛な若い葉で顕著に表れることも特徴の一つです。
当研究室では、2週間齢のイネを用いてMg欠乏症発症に至るプロセスを解明しようとしています。イネにおいては、Mg欠乏(0 mM Mg)処理期間中に最初に成長した若い葉(L5)が最もMg欠乏に対して感受性が強く、Mg欠乏開始から8日目には、デンプンの過剰蓄積と葉緑体含量の低下が見られ、それ以降にMgを再供給しても回復することなく枯死に至ります。ところが、この葉の次に成長した葉(L6)は、同時期にデンプンの過剰蓄積と葉緑体含量の低下が見られるものの、Mgの再供給によって回復することができます。つまり、上記のMg欠乏症は、葉の生死を決定づける要因ではないと言えます。そこで私たちは各葉で生じる生理活性の変化を経時的に解析し、イネの葉の枯死を決定づけるのは、蒸散活性の低下であることを明らかにしました。蒸散活性の低下は、Mg欠乏開始後6日目にL5で見られますが、L6では8日目でも見られません。デンプンの過剰蓄積と葉緑体含量の低下が見られたL6が、Mg再供給によって回復できたのは、蒸散が維持されたことで、根から再供給されたMgが流入したためであると考えられます。
私たちは現在、L5で特異的に蒸散活性が低下する仕組みを明らかにするため、Mg欠乏処理開始から数日以内での分子・遺伝子レベルの変化を調べています。
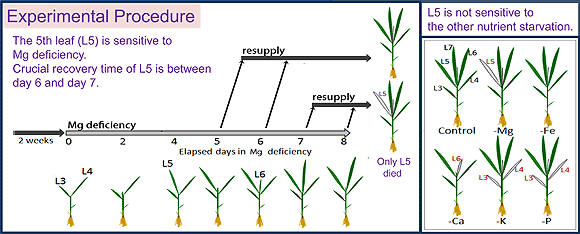
図1 Mg欠乏応答機構を解析するためのイネの水耕栽培系
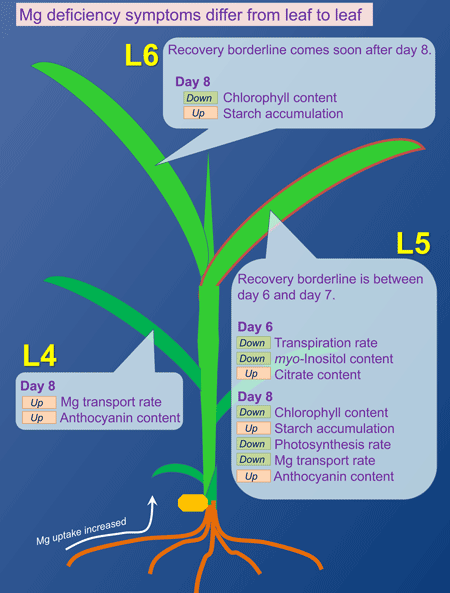
図2
L5では、Mg欠乏6日目から蒸散速度が低下し始める。8日目にはさらに低下し、根にMgを再供給しても、L5にはMgがほとんど輸送されなくなると同時に、光合成速度も低下する。L6やL4では、このような障害は見られない。






 これまでに研究してきたテーマはこちら
これまでに研究してきたテーマはこちら



