研究内容
21世紀に入り、人類は環境破壊や食糧の枯渇といった深刻な問題に直面しつつある。この問題の解決には、植物や微生物の有用な機能をより有効に活用することが重要であり、高等植物の生化学的機能の制御メカニズムや微生物の有用代謝能力の分子メカニズムを理解し、それらの基礎研究の成果を実際の問題解決へと応用することが重要である。当研究室の研究は、(1)微生物機能の解析、(2)植物機能の解析の大きく二つのテーマに分けることできる。
微生物機能の解析
一部の細菌には、環境汚染物質を分解する力、廃水を浄化する力、植物の生育をサポートする力など、人類にとって有用な能力があり、これらの力を人間は実際に利用しています。また、有害性の低い日和見病原菌が希に薬剤耐性を持つことで、深刻な問題を引き起こす場合もあります。これらの、有用・有害な微生物の機能は、様々な細菌や動植物が存在する実際の環境で発揮されています。このような機能発現のメカニズムは、試験管内で当該細菌を単独で培養するだけでは十分に理解することはできません。当研究室では、環境中ならではの微生物機能の発現メカニズムを、様々な手法を駆使して解明しています。以下に主な研究テーマを紹介します。
1:“ポストコッホ”技術を利用した微生物間相互作用の解析
多種多様な細菌が存在する環境中では、微生物は周囲の微生物と何らかの相互作用を形成して生きています。微生物が果たす機能も、この相互作用に大きく影響されますが、コッホ以来の単離・培養方法を介して単離された細菌を調べていても、相互作用の実体に迫ることは難しいのが現状です。また、人工の培地を使って容易に培養することができない大多数の細菌の存在も、解析を困難にする要因と言えます。 このような微生物集団(コンソーシア)内での微生物間の相互作用を解析するために、現在では、様々な理工学技術を駆使することができます(このような技術のことを、コッホにより完成された従来技術の“次の技術”ということで、“ポストコッホ技術”と呼んでいます)。 当研究室では、マイクロ流体デバイス、マイクロ培養アレイ、フローサイトメーター、顕微鏡技術、ラマン分光解析などを駆使して、環境汚染物質分解能の発現や薬剤耐性菌の出現に関係する微生物間相互作用の検出と機能解析を進めています。
2:遺伝子の移動が引き起こす微生物の進化と環境中での振る舞い
コンソーシア中で見られる微生物間相互作用に特徴的な現象として、遺伝子のやりとり(異種細胞間での遺伝子の移動)があります。プラスミドはそれを媒介する重要な鍵プレーヤーですが、過去のプラスミド研究は、試験管内で培養できる細菌を使って、移動(接合伝達)の機構や細胞内での保持機構の解明を目指すものがほとんどでした。そのため、様々な細菌が混在する環境中でのプラスミドの振る舞いの理解はまだまだ足りないのが実情です。そこで、当研究室では、下記のような切り口で、環境中でのプラスミド機能研究を進めています。
(1)環境中でのプラスミドの動態の分子基盤 古くから、各種プラスミドの接合伝達能力(接合伝達頻度や受容菌域)が評価されてきましたが、その際にはプラスミドを持つ細菌(供与菌)と受け取る細菌(受容菌)を混合しフィルター上や菌懸濁液の状態で静置した後に、薬剤耐性等を指標に接合伝達完了体を得て解析されていました。これらの実験の多くでは、培養できる細菌を供与菌と受容菌候補として用い、それぞれ1種ずつ混合されていました。しかし、自然環境下では細菌は多種多様な細菌とコンソーシアを形成して一緒に生息していますし、多くの細菌は培養することができません。そのため、従来の実験デザインが環境中での接合伝達能の評価には全く不十分であることは明らかです。 当研究室では、接合伝達が起きる時の条件を様々に変えて、伝達頻度などがどう変化するか調べています。特に、複数の細菌が混合している点に注目し、多数の受容菌候補が存在する時に、プラスミドを渡す供与菌(別な言い方をすれば、プラスミドそのもの)がどのように受容菌を選んでいるのかの解明を目指しています。
(2)プラスミドの機能は細菌内でどう発現するのか? プラスミドが新しい宿主細胞内に入ると、自動的に受容菌はプラスミドの機能を発揮する細菌に変わると思われていますが、これは正しいのでしょうか?この命題に答えるためには、プラスミドが宿主内でどのように機能を発揮しているのかのメカニズムを明らかにし、それが異なる宿主でどう変化するかを明らかにする必要があります。このコンセプトの下、当研究室ではプラスミド獲得前後の染色体上遺伝子の発現がどのように変化するのかを調べることで、プラスミド保持が物質代謝や転写・翻訳など宿主の生命維持に必要な機能にまで影響を及ぼすことを明らかにしてきました。また、同じプラスミドでも宿主によってプラスミド上遺伝子の発現量が変化することを見出しました。つまりプラスミドと宿主には「相性」があり、プラスミドの機能を十分に発揮するためには相性の良い宿主を選ぶ必要があります。 この「相性」を決める因子として、当研究室では核様体タンパク質(真核生物におけるヒストンのようなもの)に着目した研究を進めています。これまでの研究成果から、プラスミド由来の核様体タンパク質と宿主染色体由来の核様体タンパク質が良い関係を築き、協調的に働けることが、プラスミドの機能を安定に発揮するために重要であると考えています。最近の研究からは核様体タンパク質が翻訳後修飾を受けることも見出しており、このような修飾がプラスミドの機能に及ぼす影響についても研究を進めています。
(3)外来遺伝子の獲得が引き起こす宿主の振る舞いへの影響 プラスミドの接合伝達は、長い核酸の安全な輸送手段という意味合いがあります。そのため、合成生物学やバイオテクノロジーの分野でプラスミドの重要性は高まりつつあります。“長い核酸を安全に異種細菌に移す”というプラスミドの能力を最大限に発揮するためには、接合伝達で受け取られたプラスミドが受容菌にどのような影響を及ぼすのかを明らかにする必要があります。 そもそも、100 kbpを超えることも多い自然界のプラスミドが接合伝達した場合、受容菌にとっては大きな負担がかかると思われます。この負担(負荷)は、プラスミド保持株を非保持株と一緒に栄養培地(プラスミドの保持が有利にならない培地)で培養したときに、プラスミド保持株が集団内で淘汰されること(割合が減少すること)から、実際に検出することができます。実際、当研究室でも、分解プラスミドや薬剤耐性プラスミドが細胞に大きな負荷を与えることを見いだし、このメカニズムを解明しています。例えば、物質代謝やエネルギー代謝への影響、特殊なレギュロンやsRNAの発現が負荷の誘導に関与することを明らかにしてきました。このような研究結果からも、一般的な生育条件下ではプラスミドは宿主にマイナスの影響を与えるものと考えられており、多くの研究者に定説として受け入れられています。しかし、最近、当研究室で様々な種類のプラスミドを持ったときに負荷を感じない宿主を発見しました。この形質は従来の常識を覆すものであり、この機構解明はプラスミドを非感受的に持つことができる宿主の開発に役立つと思われます。 一方、上記の負荷を与える影響はあるとして、接合伝達直後には長鎖のDNAを受け取ったという物理的な変化がより大きな影響を与えている可能性があると考えられます。この接合伝達直後の影響と、それへの宿主細胞の適応過程は、今まで調べられたことがありません。当研究室では、上記のポストコッホ技術を使って接合伝達完了体を一細胞レベルで検出・解析することに挑戦しており、接合伝達が起きた時に受容菌細胞内で起こる変化とその後の適応過程、受容菌細胞の環境中の振る舞いをシームレスに理解しようと取り組んでいます。
3:細菌の新規微生物機能の探索と機能解明
微生物は、まだまだ知られていない、有用な能力を有していると思われます。当研究室では、環境を汚染する物質の分解菌を新規に単離し、その分解能力を理解する取り組みも実施しています。 具体的には、地下水の汚染物質として有名な塩素化エチレン類やポリ塩化ビフェニルなどの有機塩素化合物の脱塩素反応に関係する酵素の機能解析、ベンゼンの嫌気的分解反応に関与する分解菌・菌群の代謝経路の解明と分解遺伝子・酵素の解明、有機フッ素化合物分解菌・菌群の単離と解析、多環芳香族化合物分解菌群内での微生物間相互作用解析などを実施しています。
植物機能の解析
1:植物の病害抵抗性発現機構の解明
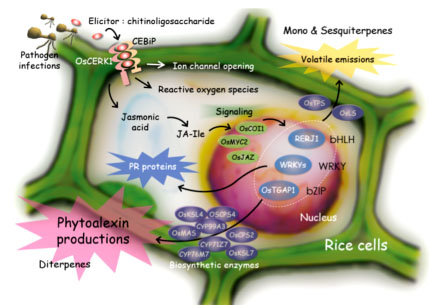
我々が実験のモデル系として用いている重要穀物のイネにおいては、病原菌感染時に病原菌由来の成分であるエリシターが細胞膜に存在する受容体と結合することにより、その感染が認識されます。また、昆虫の食害などによっても、傷害ストレスと同時に昆虫唾液内の成分がエリシターとなり植物側の防御応答を引き起こします。これらのエリシターによる初期レスポンスが引き金となることで、ジャスモン酸などの二次シグナル、エリシター・ジャスモン酸応答性の転写因子等を介したシグナル伝達を経て、抗菌性タンパク質の生成やファイトアレキシンと総称される抗菌性二次代謝産物の生産などの様々な防御反応が発揮されます。図2-1 にイネにおける病虫害応答性のシグナル伝達経路と様々な化合物生産を含む防御応答を示しました。我々は、このようなイネにおけるエリシターのシグナル伝達機構の解明を通じて、植物自身の抵抗性を活性化する方法を確立し病虫害耐性イネを作出するなど、その成果を環境保全型農業技術の開発に応用するために、以下のような様々な研究を行っています。
2:抗菌性化合物ファイトアレキシンの生合成と転写制御機構
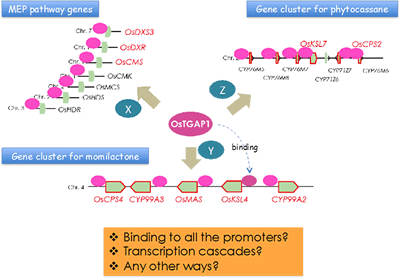
イネにおいては16種類の化合物がファイトアレキシンとして同定されていますが、そのうちの15種類はジテルペン型化合物です。我々は、山形大学・豊増知伸先生、Iowa State University・Reuben Peters先生らとの共同研究(時には競争相手として互いに切磋琢磨)により、ジテルペン型ファイトアレキシン生合成に関与するジテルペン環化酵素遺伝子をすべて単離同定し、その上流、下流の生合成遺伝子についても解析を進め、その生合成経路の全容を明らかにしてきました。その過程で、これらの生合成遺伝子群には2つの興味深い特徴があることがわかりました。1つはこれらの遺伝子群がゲノム上にクラスターを構成して存在することで、もう一つはこれらの遺伝子の発現が、病原菌ストレスに応答して一過的かつ同調的に誘導を受けることです。我々はこのようなクラスター単位での遺伝子発現制御機構を明らかにするため、制御に関与する転写制御因子の解析を進め、まず、ジテルペン型ファイトアレキシンの生産制御の鍵となる転写因子OsTGAP1を発見しました。この転写因子は、イネ4番染色体上のモミラクトン生合成酵素遺伝子クラスターの発現制御を行うだけでなく、2番染色体上のファイトカサン生合成酵素遺伝子クラスターおよび生合成上流のメチルエリスリトールリン酸経路の制御にも関与することから、ジテルペン型ファイトアレキシン生産のマスター制御因子であると考えられます(図2-2)。
OsTAGP1が図で示すように全ての関連遺伝子のプロモーターに結合するのか、あるいは他の転写因子(X, Y, Zなど)を介して発現を誘導しているのかに興味が持たれました。そこで、OsTGAP1のゲノム上の結合領域を明らかにするためChIP-seq解析(クロマチン免疫沈降と次世代シーケンスを組み合わせた手法) を行うことにしました。
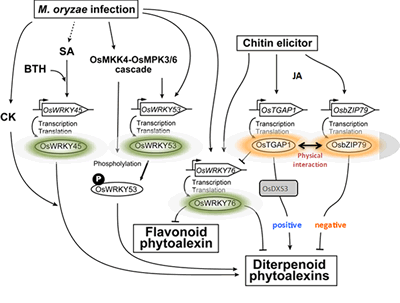
OsTGAP1がどのようにファイトアレキシン生産に関わるこれらの遺伝子群の発現を誘導しているのかを知るために、東京農業大学との共同研究で、次世代シーケンスを用いたChIP-seq解析により、OsTGAP1のゲノム上の結合領域の網羅的な同定を行いました。その結果、OsTGAP1による転写制御には、プロモーターへの直接的な結合による制御と、それ以外の領域に結合しその領域の転写を活性化するような未知の機構により進む制御が存在する可能性が示唆されました。さらに、OsTGAP1と相互作用するOsbZIP79の機能解析を進め、この転写因子がOsTGAP1とは逆にファイトアレキシン生産を抑制することを見出しました。すなわち、これら2つの転写因子は物理的に相互作用しつつ、ファイトアレキシン生産のアクセルとブレーキとして機能していることが予想されます。現在までに、OsTGAP1やOsbZIP79以外にも、ファイトアレキシンの生産制御に関わる様々な転写制御因子の存在が明らかになってきており、今後、これらの因子が織りなす転写制御の分子機構の詳細な解明が期待されます(図2-3)。
この図は、これまでに明らかになったファイトアレキシンの生産制御に関与する転写因子群の機能的関係性を表したものです。OsTGAP1はファイトアレキシン生産に対してプラスに働きますが、その際、生合成経路上流のMEP経路遺伝子OsDXS3の転写を誘導します。逆に、OsTAGP1と相互作用するOsbZIP79は、ファイトアレキシン生産に対してマイナスの影響力を持ちます。すなわち、OsTGAP1とOsbZIP79はお互いに干渉しつつファイトアレキシン生合成遺伝子の発現をファインチューニングしているものと思われます。その他にも、数種のWRKY型転写因子がファイトアレキシン生産に影響を及ぼすことが明らかになってきており、転写抑制因子であるOsWRKY76は、OsTGAP1による抑制を介して、ファイトアレキシンの生産量の調節に関わると考えています。
3:モミラクトン生合成経路の植物における進化起源の探求
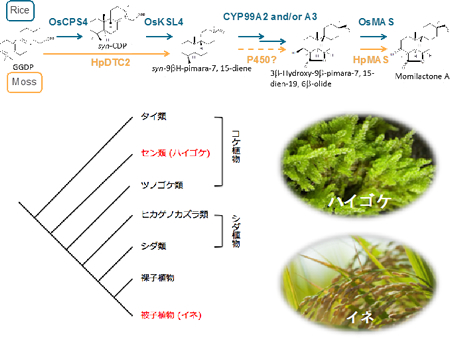
実は、イネが抗菌性化合物として生産するモミラクトンは、蘚類ハイゴケにおいてもアレロパシー物質として生産されます。イネ以外にモミラクトンを生産する生物は、今のところハイゴケのみであり、進化的にかけ離れたコケとイネが、どのようにモミラクトンの生合成能を獲得あるいは進化させてきたのかは大変興味深いところです。そこで、コケの二次代謝産物研究に詳しい東京農工大学・川出洋先生と岡山理科大学・林謙一郎先生との共同で、蘚類ハイゴケの生産するファイトアレキシン・モミラクトンの生合成経路の解明に着手しました。まず、塩化銅ストレスによりモミラクトンの生産を誘導したハイゴケを用いてRNA-seqを行い、モミラクトン合成の初発と最終段階を担うそれぞれの酵素遺伝子(HpDTC2とHpMAS1)の取得に成功しました。HpDTC2に関してはプロモータ領域を取得し、この配列内にストレス応答領域が含まれることをつきとめています。今後、これらの生合成遺伝子の発現制御に関わる因子を探索し、また、モミラクトン生合成遺伝子クラスターがハイゴケにも存在するのかどうかなど、モミラクトン生合成経路の制御システムの進化について追究していきたいと考えています(図2−4)。
ハイゴケのピマラジエン合成酵素は二段階の環化反応を担う二機能酵素でしたが、最終段階を担う脱水素酵素HpMASとOsMASはアミノ酸の保存性が非常に高いことがわかりました。ハイゴケのモミラクトンン生合成遺伝子がイネと同じようにクラスターを構成しているのかどうか、また、これらの植物の間で転写制御機構は保存されているのかなど興味は尽きません。今後もモミラクトン生合成遺伝子クラスターの制御機構の分子進化についての解明を進めていきます。
4:植物における適応代謝産物の生産とジャスモン酸シグナル伝達経路の関係
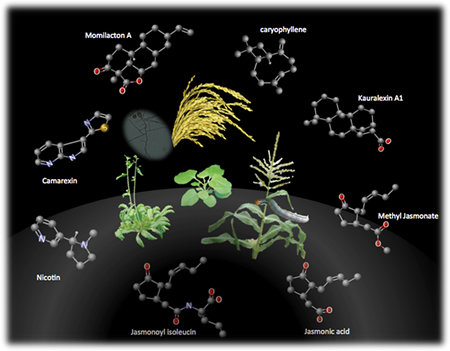
植物は非常に多くの二次代謝産物を生産しますが、その中でもテルペノイドやフラボノイドに分類される化合物は、自然界に2万種以上存在することが知られています。上記テーマで述べたファイトアレキシンも、植物の病害抵抗性発現の際に誘導的に生産される炭素数20のジテルペノイド化合物の1つです。また、イネでは唯一のフラボノイド型ファイトアレキシンとして、サクラネチンも知られています。二次代謝産物の多くは機能未知のものが多く、一次代謝産物と比較するとその重要性が低いと思われがちです。しかし、すでに述べたファイトアレキシンのように、長い進化の過程で植物の生存戦略の1つとして利用され続けていることを考えると、多様な環境変化に対応するために合成能を獲得し維持し続けることで持ち得た重要な化合物「適応代謝産物:Specialized metabolite」と呼ぶことができるのではないでしょうか(図2−5)。
図は、双子葉植物の代表としてシロイヌナズナとタバコ、単子葉植物の代表としてトウモロコシ、イネにおいてそれぞれ報告されているジャスモン酸によって生産誘導を受ける化合物を示しています。下に位置する2つの化合物がジャスモン酸とその活性化体であるジャスモノイルイソロイシンの構造です。ここに示したジャスモン酸によって生産誘導を受ける化合物は、それぞれ病虫害抵抗性で機能する適応代謝産物:Specialized metaboliteであり、環境に適応するために植物の生存戦略の1つとして利用されてきたものと理解できます。
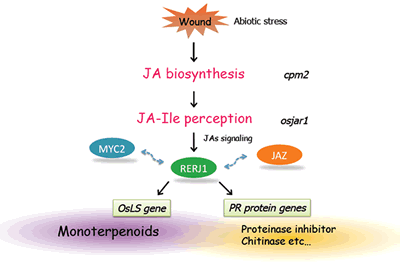
このような適応代謝産物の多くは、植物ホルモンのジャスモン酸により生産誘導を受けることが広く知られています。我々は様々な適応代謝産物の生産におけるジャスモン酸を介したシグナル伝達経路の役割を明らかにするため、ジャスモン酸の下流で働く転写制御因子について解析を進めています。その一例としてあげられるのが、イネから単離したRERJ1です。この転写因子はジャスモン酸早期応答性のbHLH型転写因子であり、傷害によっても速やかに転写レベルでの誘導を示します。RERJ1の変異体の解析を進めたところ、アワヨトウによる食害実験において、野生型株よりも食害を受けやすい、すなわちRERJ1の変異体は昆虫に取って食べやすいことになります。これによりRERJ1が昆虫に対する抵抗性を発揮するために必用であることが示唆されました。現在、RERJ1によりどのような遺伝子が発現変動をうけることで、虫害抵抗性に寄与するのかを追究しており、昆虫の摂食後の消化を阻害するプロテイナーゼインヒビターや昆虫誘因に関わる香気性テルペンの生産に対する影響が明らかにされつつあります(図2−6)。
RERJ1は虫害・傷害などのストレスにより生産されるJA-Ileを介したシグナルにより発現誘導され、モノテルペン生合成遺伝子の発現や、その他多くのPRタンパク質遺伝子の発現を、傷害部位特異的に誘導する転写因子であると考えられます。また、JAシグナリングの要となるJAZ遺伝子の発現誘導にも関与することから、JAZの発現誘導を制御することが知られるJAシグナルのマスター転写因子MYC2の下流、あるいはMYC2と協調的に働くことで、JA応答性遺伝子の発現制御を可能としている可能性も考えられます。現在、RERJ1の直接的な標的遺伝子の単離、MYCやJAZとの物理的相互作用の有無、さらにはRERJ1遺伝子自体の誘導を制御する因子の探査を進めています。