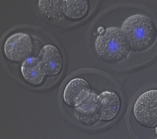
受精開始から数回の卵割分裂にかけて、1)娘細胞核の形成に、Kidによる分裂後期染色体コンパクションが必要である 2)核が多核になっても細胞周期を止めない という特徴があることがわかってきました。また、カエルなど哺乳類以外の脊椎動物の受精・卵割過程とは、細胞周期制御などに大きな違いがあることもわかってきました。Kid欠損マウスはこの時期特異的に異常を示す、世界で唯一の変異マウスです。この利点を活かし、また体細胞分裂やカエルの卵・初期胚分裂過程との比較を通して、受精〜卵割過程における哺乳類特有の細胞分裂機構の解明をめざします。
雌性減数第二分裂での前核形成タイミング制御機構の研究
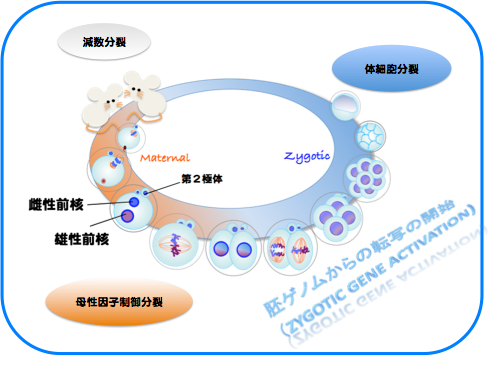
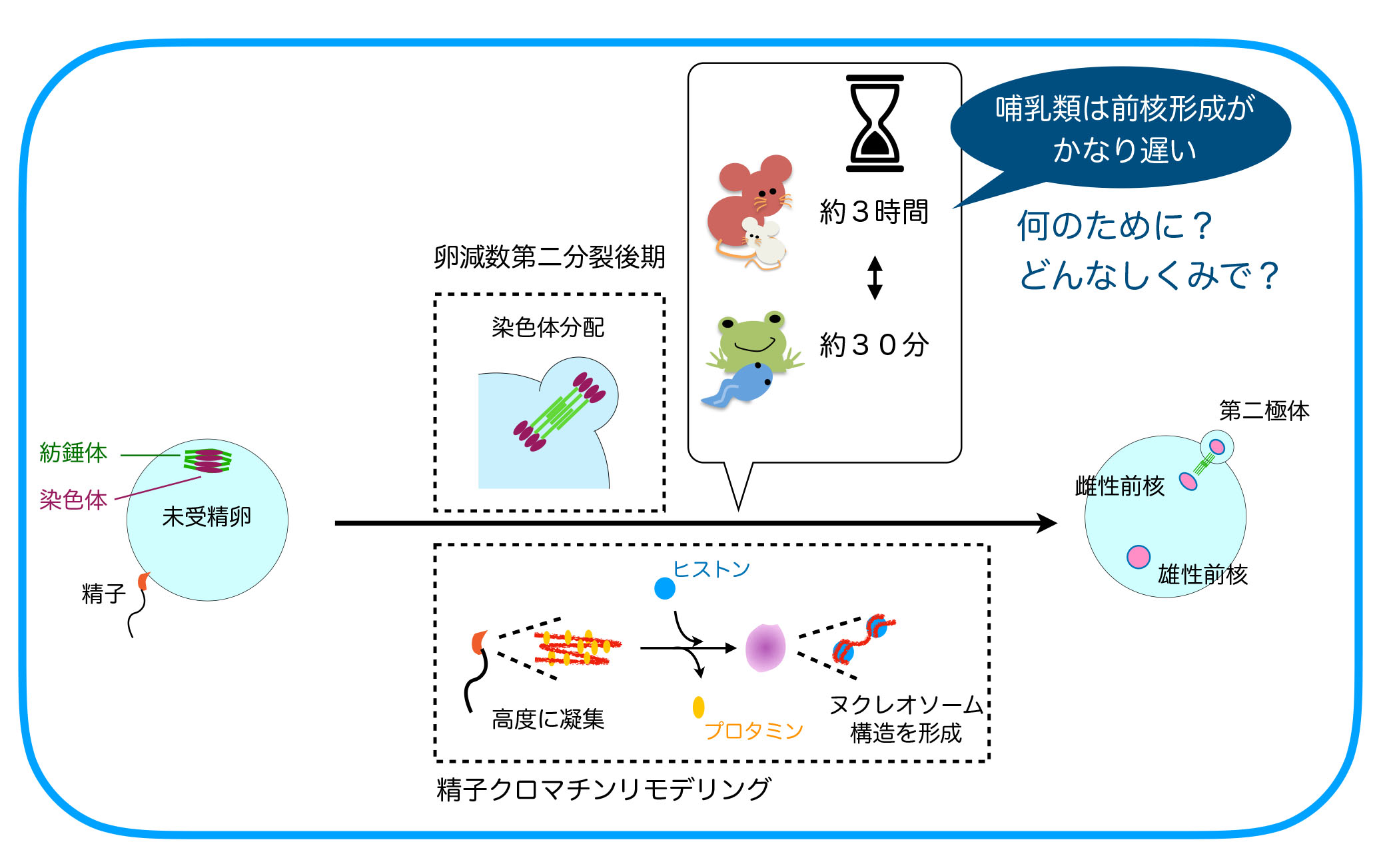
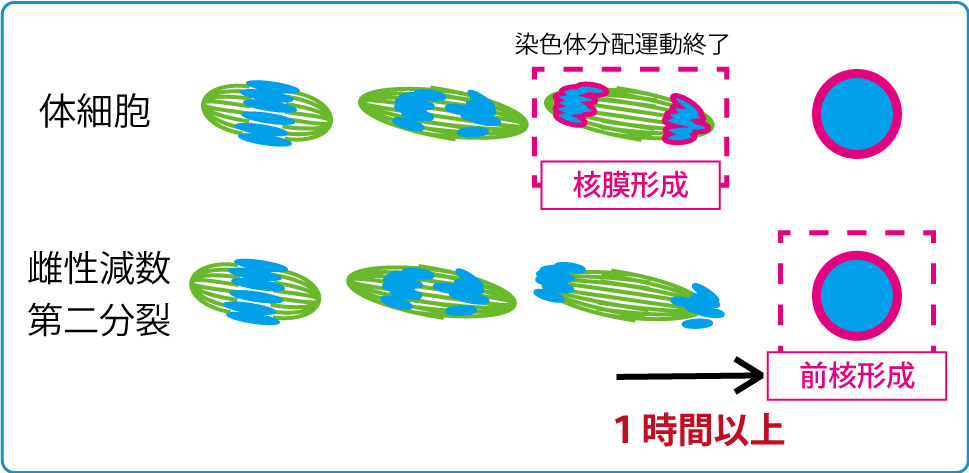
受精開始時点で、精子と卵の細胞周期は異なっており、減数分裂を完了している精子に対し、卵細胞は減数第二分裂の中期(MetaII)停止しています。精子との融合後に減数第二分裂の後期(AnaII)が始まりますが、AnaIIは卵割分裂を含む体細胞分裂の後期やカエルなど非哺乳類脊椎動物卵のAnaIIとは明らかに異なった特徴が見られます。それは核膜形成タイミングの違いです。体細胞分裂やカエル卵では染色体分配後に引き続き起こる核膜形成は染色体分配運動が終了すると直ちに起こりますが、雌性減数第二分裂時の核(雌性前核)形成は染色体分配運動が終了してから1~2時間経った後に開始されます。この雌性減数第二分裂時での特徴的な核膜形成タイミングの制御機構とその生理的意義は何でしょうか。
前核形成とMOS-MEK-ERK-RSK経路
私たちはまず、Mos-MAPK経路という未受精卵の細胞周期を制御する経路に着目し解析を行いました。これまでの説では受精後しばらく経った後にMAPK活性が下がると前核形成が開始すると考えられてきました。私たちはこれを精査すべく、活性型リン酸化ERK免疫染色によるMAPK活性測定と前核観察を同時に同じ卵で行いました。その結果、これまで考えられてきたこととは異なりMAPK不活性化前から前核形成が開始することが明らかとなりました。次にMAPKやその下流因子のRSK(Ribosomal S6 kinase)の薬剤による不活性化を行ったところ、染色体分配運動終了後すぐの前核形成は起きなかったものの、前核形成が少し早まることがわかりました。RSKは、多くの動物卵において卵の減数分裂をMetaIIで停止させる活性、Cycto Static Factor (CSF)を担うシグナル経路の一員ですが、マウス卵ではRSKがなくてもMetaII停止します。哺乳類の卵でRSKが何をしているのか長年不明でしたが、この実験結果はRSKが前核形成を抑制する活性をもつことを示唆しています。以上の結果からMos-MAPK経路はRSKを介して前核形成を負に制御していること(図中のMAPK-RSK-X経路)、しかしその制御は部分的であり前核形成タイミングの決定はさらに別の経路が関与すること(図中のY-X経路)が示唆されました(Soeda S. et al., Genes to Cells 18, 850-858, 2013)。
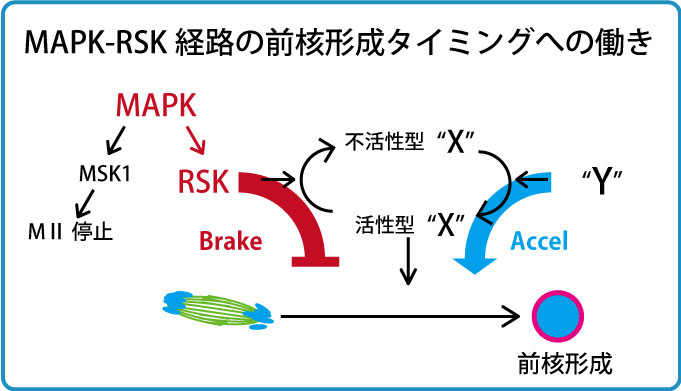
哺乳類卵AnaII特有の核形成タイミング制御システム:RSK-MASTL経路
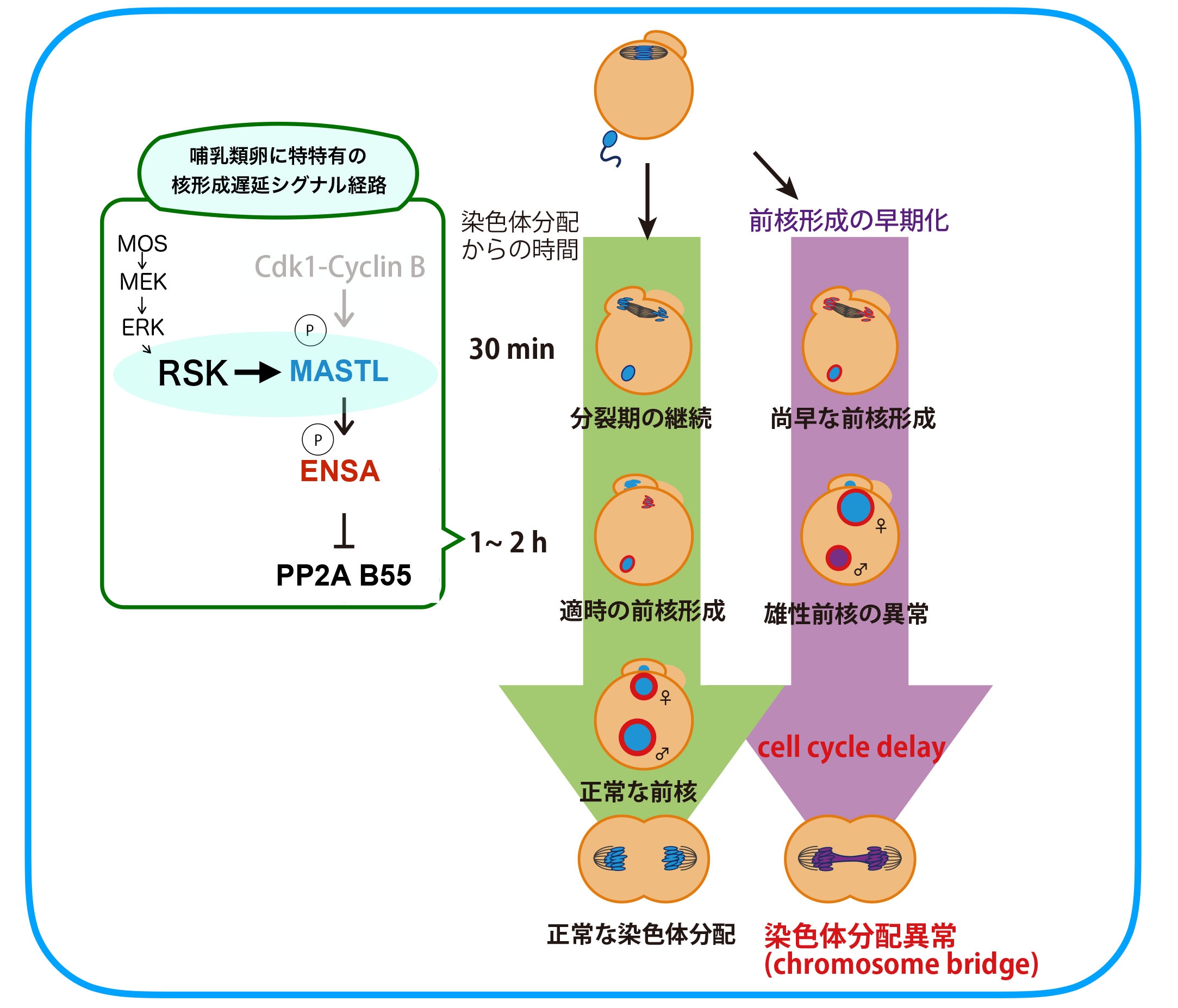
次にRSKの下流、上の図でいうXにあたる分子群について解析を進めました。体細胞分裂では、分裂後期に入るまで核再形成に必要な脱リン酸化酵素PP2A-B55を抑制するための経路が存在します。すなわち、Cdk1-Cyclin Bによって活性化されたGreatwall(Gwl)/MASTL(哺乳類での名称)キナーゼがENSA/ARPP19をリン酸化し、リン酸化ENSA/ARPP19がPP2A-B55を抑制する経路です。後期に入りCyclin
Bが分解されてCdk1が失活するとこの抑制経路の制御が次々とOFFにされ、約10分後にはPP2Aの活性化と核再形成が起こります。カエル卵で調べたところ、やはりCdk1の不活性化から15-20分後にはGwlやENSAの脱リン酸化が起こっていました。一方、マウス卵では2時間たってもMASTLのリン酸化が保たれており、これが前核形成タイミングが遅い原因であることがわかりました。そこで次にRSKとこの経路との関連を調べ、RSKがMASTLをリン酸化し(Cdk1とは異なる残基)活性化することを見つけました。RSKは受精開始後も2-3時間活性を保つためマウス卵ではMASTLやENSAのリン酸化も2-3時間保たれることになります。RSKによるリン酸化標的配列は哺乳類のMASTLには広く保存されていましたが他の脊椎動物のGwlにはなく、このことが哺乳類特有の時間制御の一因であることもわかりました(Soeda S. et al., Dev. Cell 47, 363-376, 2018)。
哺乳類受精卵は前核形成を遅くすることで精子クロマチンリモデリング完了を保証している
では、受精開始から前核形成まで数時間かかることは、哺乳類の受精成立にとってどのような重要性があるのでしょうか。この問題にアプローチするために、マウス受精卵での前核形成までの時間を人為的に短縮することに挑戦しました。核再形成は脱リン酸化酵素のはたらきによって起こることから、様々な脱リン酸化酵素をマウス卵に発現させ試したところ、PP1の発現により前核形成をカエル並に早期化することができました。
すると、精子由来の雄性前核には、①小型化、②ヒストンH3.3取り込み量の減少、③DNA損傷の増加といった異常が見られ、細胞周期の遅延が起こった末に第一卵割分裂において染色体がきちんと2細胞期割球に分配されない(染色体ブリッジ形成)という異常が頻発しました。こうした異常は雌性前核にはほとんど見られず、また、PP1を前核形成直後に発現させた場合や、前核形成を早期化した二倍体雌性単為発生胚でも見られませんでした。さらに、卵の単為発生を開始させて1時間ほどしてから精子を顕微注入する、という手順によって精子が卵細胞質に入ってから雄性前核ができるまでの時間を短くしたところ、PP1発現による前核形成早期化受精卵と同様の異常が見られました。これらの結果から、哺乳類の受精卵中での前核形成タイミングが遅い、ということには時間がかかる精子クロマチンリモデリングの完了を保証する、という重要性があることが示されました(Soeda S. et al., Dev. Cell 47, 363-376, 2018)。しかし、なぜ哺乳類でだけ精子クロマチンリモデリングに時間がかかるのか、核膜で覆われる前でないと完了できない精子クロマチンの変化とは具体的に何か、など、今後取り組むべき課題も残っています。
初期発生における雌雄染色体コリオグラフィーについての革新的研究
また、Maternal Divisionがその後の体細胞分裂による個体発生に果たす意義は何か、という点に対しても、「胚ゲノムからの転写開始」との関連に注目した解析をすすめています。そのために、まずは受精前から4細胞期の終わりまでの間に、卵、精子、それぞれに由来する染色体にどのような変化が起こるのかについての網羅的な解析を、東大・東工大 共同研究チームの一員として行いました。4細胞期までの受精胚ならびに単為発生胚を各ステージ10,000個準備し,トランスクリプトーム解析を行って,従来のマイクロアレイ実験に比べ,著しく高感度の発現プロファイルを構築しました。さらに,既存のデータベースと比較することで,817遺伝子が受精による新規転写産物・精子由来因子の候補であることを見出しました。さらに,タンパク質をコードしていないRNA(non-cording RNA)の重要性も明らかになりつつあります(Park S.J., et al., Genes Dev. 28, 2736-2748, 2013)。
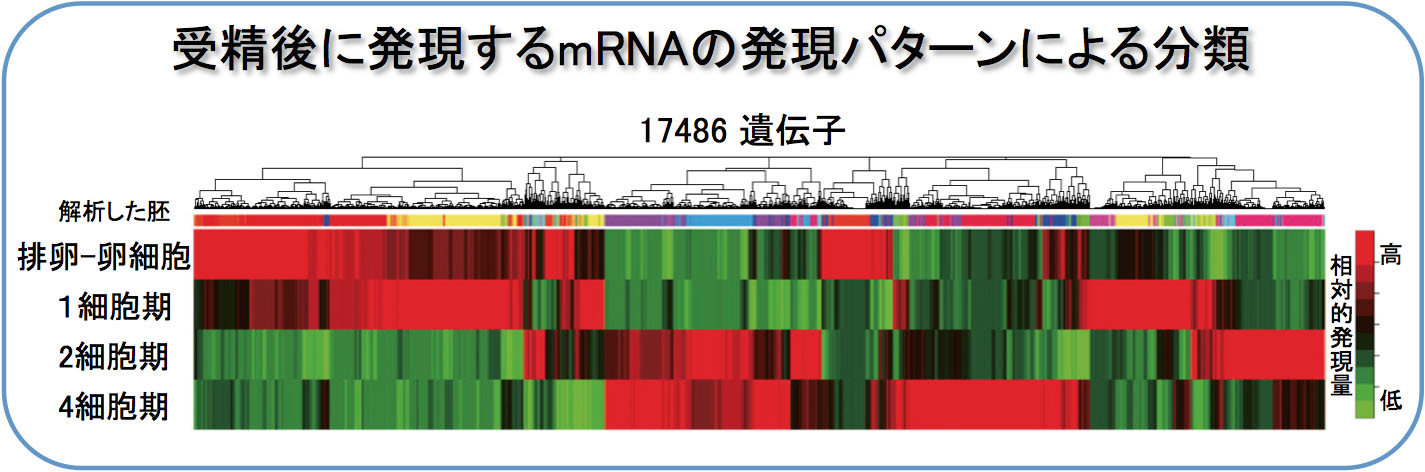
今後,さらに解析を進め,初期胚における雌雄ゲノムの相互作用機構について解明していく予定です。
なお,本研究で構築したデータベースは,東京大学ヒトゲノム解析センターのホームページ上(http://dbtmee.hgc.jp)にて公開しており,参照して頂ければ幸いです。
関連リンク
セルイノベーション研究課題 初期発生における雌雄染色体コリオグラフィーについての革新的研究
マウス初期胚転写産物データベース (Park, S.J., et al., Genes Dev., 2013)