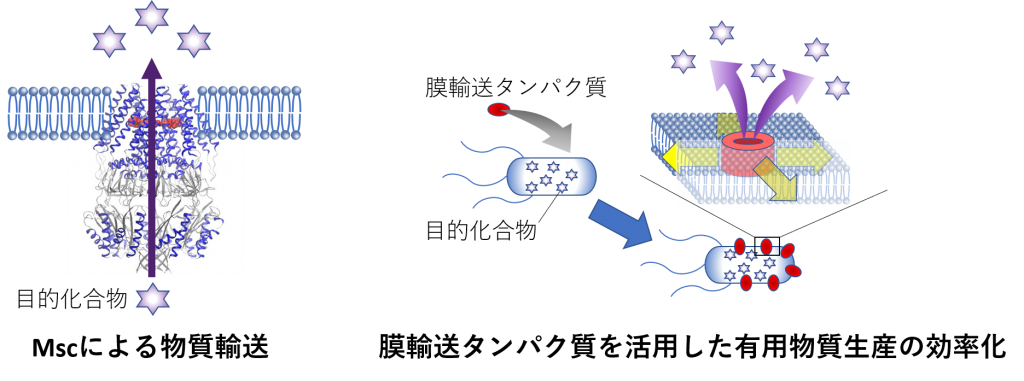
研究テーマ
1. 有用物質生産のための膜輸送タンパク質の解析と応用
社会の持続可能性をさらに高めるために、再生可能資源からの有用物質生産に対する期待がますます高まっています。最近のシステム代謝工学、合成生物学、生合成研究などの飛躍的発展によって微生物細胞内に目的化合物を大量に蓄積させることが可能になってきていますが、そのようにして細胞内に蓄積された目的化合物が細胞膜を超えて細胞外に効率よく輸送されるとは限らず、しばしば微生物発酵技術のボトルネックとなっています。私たちは、グルタミン酸の工業生産に利用されているCorynebacterium glutamicumのNCgl1221遺伝子産物が膜張力で活性化されるメカノセンシティブチャネル(Msc)であること、このMscがグルタミン酸排出を直接担うこと、基質寛容性があること、その輸送にはATP等は不要であることなどを明らかにしてきました。これらは、長年のグルタミン酸排出機構の議論に一定の決着をつけたばかりでなく、エネルギー依存性についての定説を覆すものです。さらにこのMscが、生理的膜電位の下では、他のMscとは異なるグルタミン酸生産に有利な特性を持つこと明らかにしました。微生物発酵技術のボトルネック解消に向けて、膜輸送タンパク質のさらなる解析と共に膜輸送タンパク質のデザインを目指した研究も進めています。
1. Analysis and Application of Membrane Transport Proteins for Production of Useful Materials
Expectations for the production of useful materials from renewable resources are increasing progressively to further enhance the sustainability of society. Recent breakthroughs in systems metabolic engineering, synthetic biology, and biosynthetic study have made it possible to accumulate large quantities of the desired compounds in microbial cells. However, the intended compounds accumulated in cells in this way are not always efficiently transported across the cell membrane to the extracellular space, often becoming a bottleneck for microbial fermentation technology. We have shown that the NCgl1221 gene-product of Corynebacterium glutamicum, which is used in the industrial production of glutamate, is a mechanosensitive channel (Msc) activated by membrane tension. In addition, this Msc is directly responsible for glutamate excretion, substrate-tolerant, and does not require ATP for its transport. This not only settled the long-standing debate on glutamate excretion mechanisms but also overturned the dogma of energy dependence. Furthermore, this Msc was shown to have favorable properties required for glutamate production, which are different from other Mscs under physiological membrane potential. In order to resolve the bottleneck of microbial fermentation technology, we are also conducting research aimed at understanding the design of membrane transport proteins along with their further analysis.
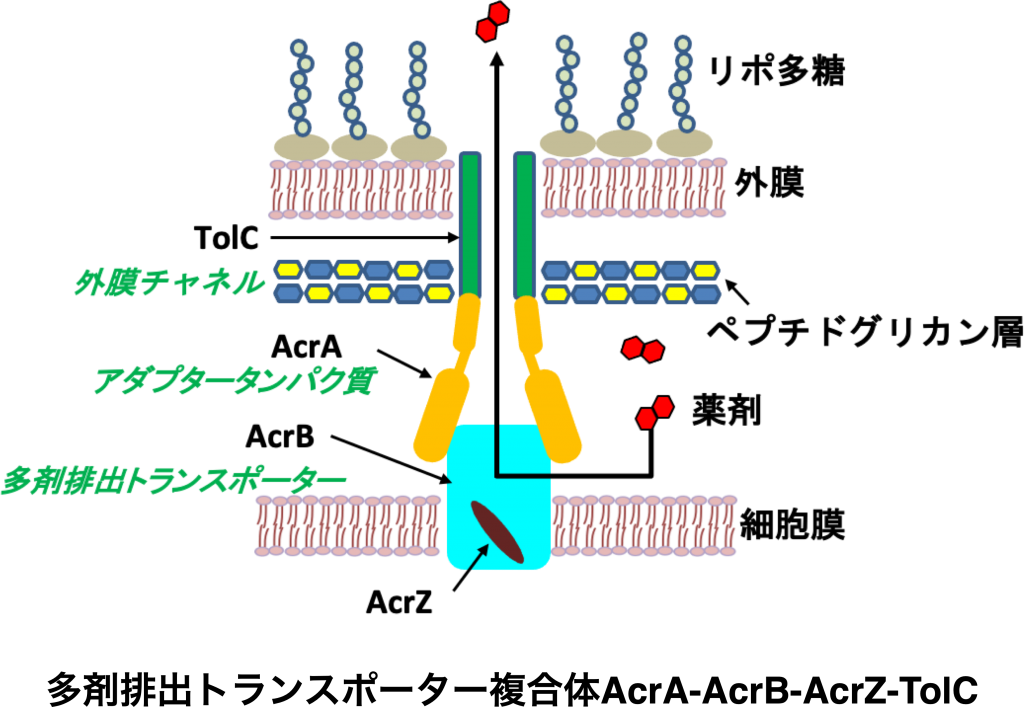
2. 分子動力学シミュレーションを用いた膜輸送タンパク質における基質輸送の解析
近年、病原性細菌やがん細胞に対して薬が作用しなくなる「薬剤耐性化」は病院だけでなく、養殖や畜産の現場でも大きな問題となっています。この原因の一つと考えられているのが、多剤排出トランスポーターという膜輸送体です。多剤排出トランスポーターは病原性細菌やがん細胞の細胞膜に存在し、さまざまな薬剤や毒物などの異物を認識して細胞の外に輸送するはたらきをします。大腸菌、緑膿菌などのグラム陰性菌では、細胞膜の外側に細胞外膜をもっているため、薬剤などの輸送は細胞膜にある多剤排出トランスポーターと細胞外膜にある外膜チャンネル、そして両者をつなぐアダプタータンパク質などからできた複合体が行っています。これまで多剤排出トランスポーター本体については、実験やシミュレーションによってその薬剤排出のメカニズムが研究されてきましたが、複合体全体ではよくわかっていません。私たちの研究室では分子動力学(Molecular Dynamics: MD)シミュレーションと実験を組み合わせて、このような多剤排出複合体全体での薬剤排出機構の解明と薬剤などの輸送を阻害する要因を見つけることを目指して研究を進めています。
2. Analysis of Substrate Transport in Membrane Transport Proteins Using Molecular Dynamics Simulations
In recent years, “drug resistance”, in which drugs cease to act against pathogenic bacteria, has become a major problem not only in hospitals but also in aquaculture and livestock farming. One of the possible causes of this is a membrane transporter called multidrug efflux transporter. The multidrug efflux transporter exists in the plasma membrane of pathogenic bacteria and functions to recognize foreign substances such as various drugs and poisons and transports them out of the cell. Gram-negative bacteria such as Escherichia coli and Pseudomonas aeruginosa have an outer cell membrane outside the cell membrane. Thus, drugs are transported by a complex made up of a multidrug efflux transporter in the plasma membrane, an outer membrane channel in the outer cell membrane, and an adaptor protein that connects these two. Until now, the mechanism of drug efflux was studied through experiments and simulations in the multidrug efflux transporter itself; however, research on the entire complex is lacking, and the mechanism of drug efflux overall is not well understood. Our laboratory combines molecular dynamics simulations and experiments to elucidate the mechanisms of drug efflux via these multidrug efflux complexes and identify factors that inhibit drug transport.
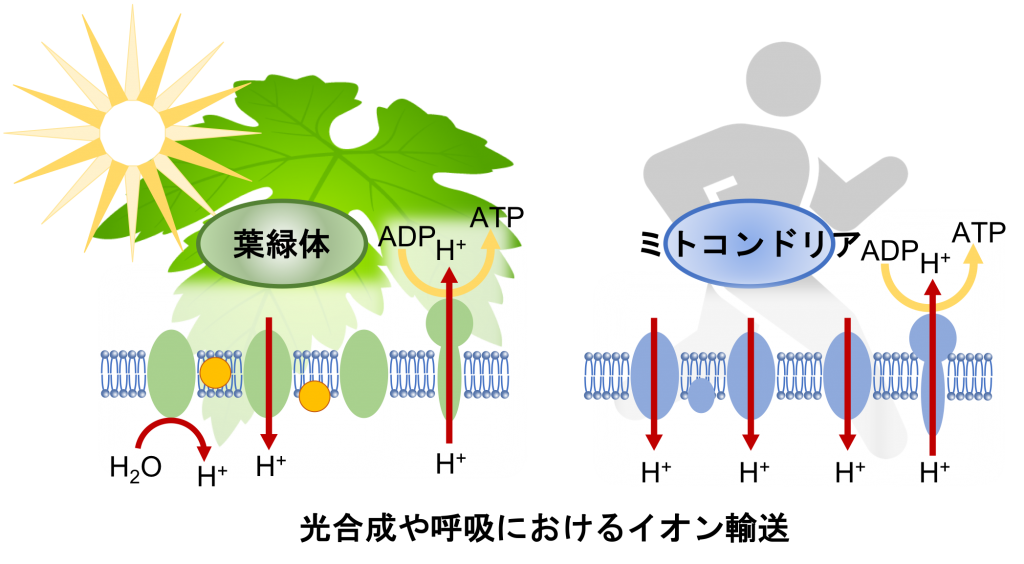
3. 光合成や呼吸におけるイオン輸送の解析
生物がエネルギーを獲得する呼吸や光合成の根幹の一つはイオン輸送です。食物の酸化や光から得られるエネルギーは水素イオン駆動力に変換され、それがATP合成に使われます。水素イオン駆動力の生成と調節には、水素イオンばかりでなく複数種のイオン輸送が関わっています。我々は世界で初めて呼吸酵素による水素イオン輸送を電流値として記録することに成功しています。また、呼吸酵素による水素イオン輸送について議論が続いている課題に決着をつける可能性があるデータを得ています。光合成については、水素イオン駆動力の調節に重要な陰イオン輸送タンパク質の解析と共に、多数のイオン輸送タンパク質で構成された複雑な光合成システム全体を理解するための実験方法の開発も進めています。光合成や呼吸についてさらに理解を深め、微生物発酵生産において呼吸効率を高める、環境に適した光合成能を付与するなど社会の持続可能性を高める応用への展開も図っていきます。
3. Analysis of Ion Transport in Photosynthesis and Respiration
Ion transport is one of the bases of respiration and photosynthesis in which organisms acquire energy. The energy from food oxidation and light is converted into proton motive force, which is used for ATP synthesis. The generation and regulation of proton motive force involve hydrogen ions and multiple types of ion transporters. We have succeeded for the first time in recording hydrogen ion transport through respiratory enzymes as an electric current value. We are also developing experimental methods to understand the entire complex photosynthetic system composed of several ion transport proteins, along with the analysis of ion transport proteins that are important in regulating proton motive force during photosynthesis. Thus, we will further deepen our understanding of photosynthesis and respiration, and work to develop applications that enhance the sustainability of society, such as improving respiratory efficiency in microbial fermentation production and imparting photosynthetic capacity suitable for the environment.
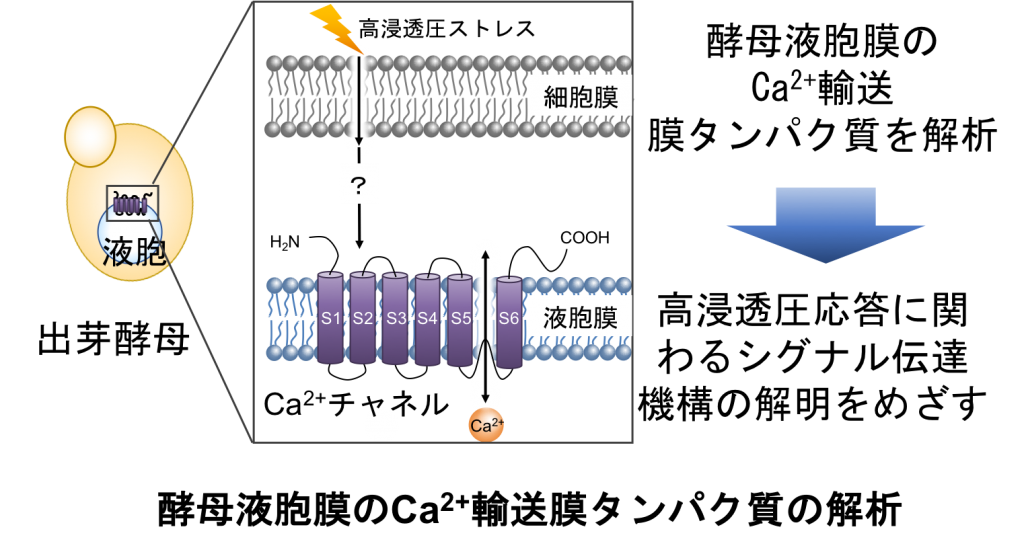
4. 高浸透圧ストレスに応答する出芽酵母液胞膜のCa2+チャネルの電気生理学的解析
工業的利用と基礎研究の両分野で重要な出芽酵母(Saccharomyces cerevisiae)は高浸透圧ストレスに晒されると、液胞膜のCa2+チャネルが活性化して液胞から細胞質にCa2+を放出することが知られています。しかし、高浸透圧ストレスを感知してCa2+チャネルが活性化する分子機構は明らかになっていません。我々は、これまで困難とされてきたイオン輸送体の機能解析に効果的であるパッチクランプ法の出芽酵母への適用に成功し、本Ca2+チャネルの電気生理学的解析と生理的役割の解明を進めています。細胞外の浸透圧変化を感知して応答するイオンチャネルは真核生物に広く保存されており、この普遍的でありながら未知のメカニズムの解明を目指しています。
4. Electrophysiological Analysis of Ca2+ Channels in Saccharomyces cerevisiae in Response to Hyperosmotic Stress
When Saccharomyces cerevisiae, which is important in industrial applications and basic studies, is exposed to hyperosmotic stress, Ca2+ channels in the vacuolar membrane are activated and release Ca2+ from the vacuole into the cytoplasm. However, the molecular mechanism by which Ca2+ channels activate by sensing hyperosmotic stress is unclear. We have successfully applied the patch-clamp technique, which is effective in analyzing the function of ion transporters and has been considered difficult so far, to Saccharomyces cerevisiae, and are advancing with electrophysiological analysis and elucidation of the physiological roles of this Ca2+ channel. Ion channels that sense and respond to changes in extracellular osmotic pressure are widely conserved in eukaryotes, and we aim to elucidate this universal but unknown mechanism.