増える人工細胞をつくる
研究の背景
未解決問題
生物の大きな特徴の一つは自律的に増えることです。生物は適切な栄養を与えてやればいくらでも増えることができ、この能力のために生物は食料やバイオ医薬品などの有用な有機物の生産に利用されています。しかし生物は人間の都合よくはできていません。ほとんどすべての作物は特定の気温や日照量や雨量を要求するため、いくらでも栽培できるわけではありません。ウナギやマツタケなど美味しくても養殖ができず絶滅に瀕しているいる生物もいます。このような点で、生物を使ったものづくりは工業製品の生産とは大きく異なります。工業製品であれば、必要な品質の商品を設計し必要な分だけ作ることができますが、生物を使った有機物の生産は、設計もできず生産量も不安定になります。これまでに品種改良や遺伝子組み換えにより、生物の性質を変える試みがなされていますが、ゲノム情報をいじることで変えられるのは生物のもつ抹消のわずかな性質にとどまります。種が変わるような大きな変化を起こすことはできません(注1)。
仮に生物を大きく変えることができたとしてもそこには危険性が付きまといます。今だ人間は大腸菌のような単純なモデル生物ですら、すべての遺伝子の機能をわかっているわけではありません。ましてモデル生物ではないほとんどすべての生物については、大部分は分かっていないと言ってもよいかと思います。そのどうやって動いているのかわからない生物を改変して思ったように動作させることは困難であるだけではなく、何が起こるかわからない危険性もあるように思います。例えるならば、失われた高度な古代文明の遺物を掘り出して原理もわからないまま使っているようなものです。設計原理を分かっていないものを安全に動かしたり、自由に制御したりできるはずもありません。
注1: なぜ種をまたぐような大きな変化はできないのでしょうか? これができれば既存の生物にこだわる必要がなくなります。たとえばウナギを捕らなくても、養殖しやすい魚の肉をウナギと同じ構造に変えればよくなります。さらに植物にウナギの肉を実らせることができればもっと手軽です。しかし、もちろんそんなことはできません。生物の発生過程は未だ人間が改変できるようにはなっていません。その理由は未だその分子機構が明らかではないという可能性もありますが、個人的にはどんなに分子機構が明らかになったとしても、やはり自由に改変などできないのではないかと思います。その理由は進化の仕組みにあります。進化というしくみはもともとあったしくみに新しいものを付け加えることで新機能を達成します。もともとの仕組みを一度壊して作り直すことはできません。それは一度壊した時点で死んでしまうか、壊さなかったものとの競争に負けてしまうからです。したがって、もともとある仕組みを利用しながら新機能を追加していくことになります。そのように進化していくと、新しい機能は古い機能に依存した形で付け加えられていくために、古ければ古いほどもう変えることができなくなっていくはずです。こうして進化的に古い機能(例えば発生にかかわる遺伝子など)は、少しの変化も許されなくなっていく傾向があるのではないかと思います。
私たちの戦略
そこで私たちは、人間の手で1から設計し、ブラックボックスのない、しかし生物のように有機物質からできていて増える能力を持つシステムが必要だと考えました。それを(細胞である必要はありませんがわかりやすいので)「増える人工細胞」と呼んでいます。自分たちで機能の良く分かった材料のみから組み立てますから、安全性も制御性も高くなります。このような人工細胞ができれば、これまでの非効率で不安定な生物を使ったものづくりを置き換える革新的な技術になると考えています。
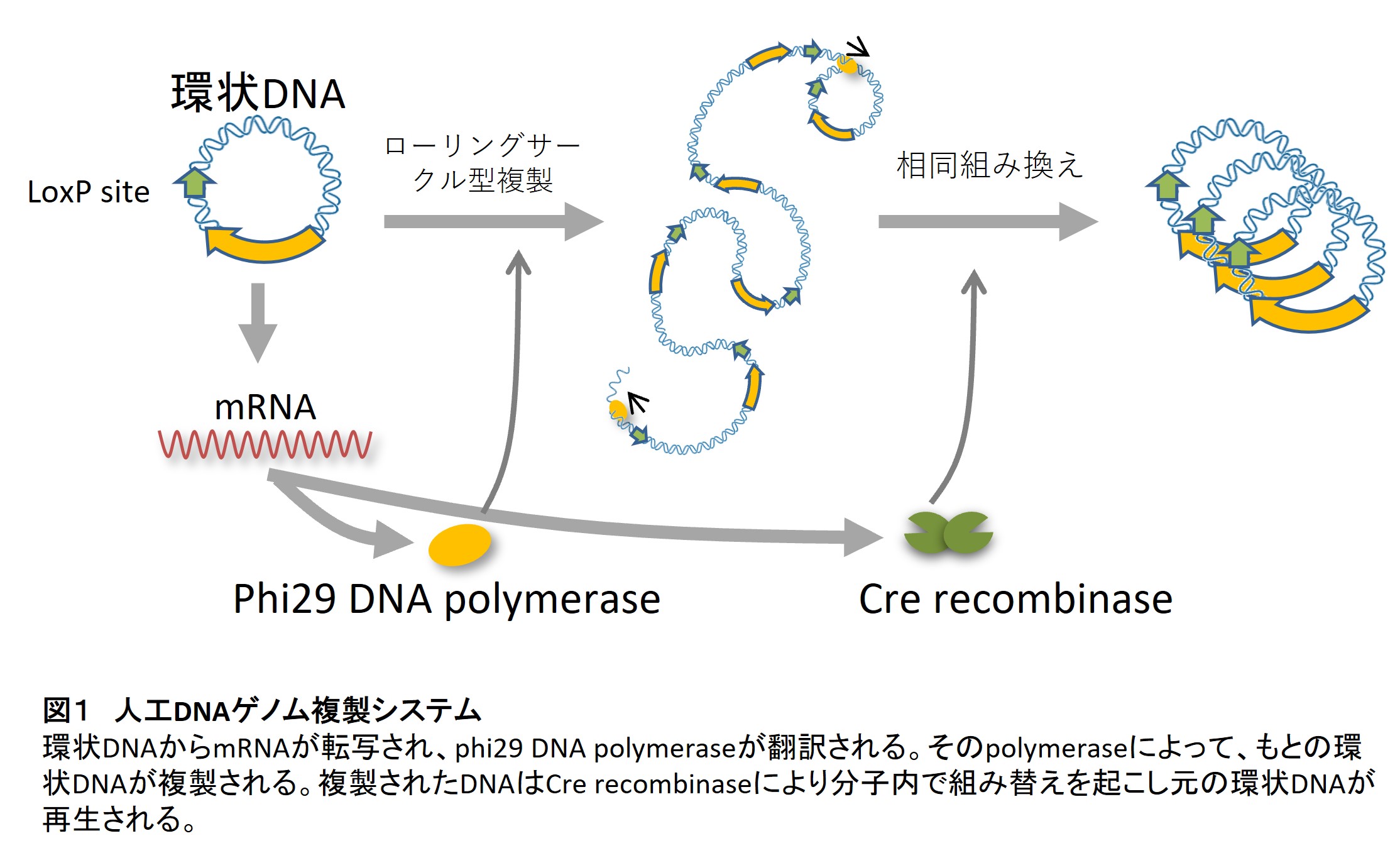
未だ増える能力をもつ分子システムは開発されていません。これを開発するためには、まず増えるセントラルドグマを作る必要があると考えています。セントラルドグマとは、細胞内の遺伝情報の流れのことで、具体的には1.DNA複製、2.DNAからRNAの転写、3.RNAからタンパク質の翻訳、のことを指します(図1)。この反応に関わるRNAとタンパク質をすべてDNAにコードさせ、そこから発現したRNAとタンパク質によりセントラルドクマを動かすことができれば、このセントラルドグマ全体を自律的に増やすことができるはずです。

これまでの成果
転写・翻訳と共役したDNA複製システムの開発
増えるセントラルドグマの開発には、まずDNA複製を再帰的にする必要があります。つまり、複製される人工ゲノムDNAにDNA複製に必要な遺伝子をすべて載せておいて、そこから発現したタンパク質群によりDNA複製が続くようにする必要があります。そのために大きなハードルの一つは、天然に存在するDNA複製機構の複雑さです。大腸菌のDNA複製には約20の遺伝子が関与しています。ウイルスのDNA複製でもこれまでに再構成された最少のもの(phi29 bacteriophage)でも4 遺伝子が必要です。しかもそのうちいくつかの遺伝子はかなりの濃度(μMオーダー)で発現させる必要があり、本研究で用いるような再構成型の無細胞翻訳系では達成が困難です。そこで私たちは、どんな天然のDNA複製よりも少ない要素で達成可能な人工DNA複製システムをデザインし、実現させることにしました
私たちはForsterらの提案している方法(Forster and Charch 2006)に基づいてDNA複製酵素をコードした環状DNAとDNA組み替え酵素を使うことにより、環状DNAからローリングサークル型のDNA複製を行った後にDNA組み替え酵素により再び環状DNAを合成するシステムを作りました(1)(図2)。このシステムは、現在までに等温で再帰的にDNAを複製できる最も単純なシステムです。
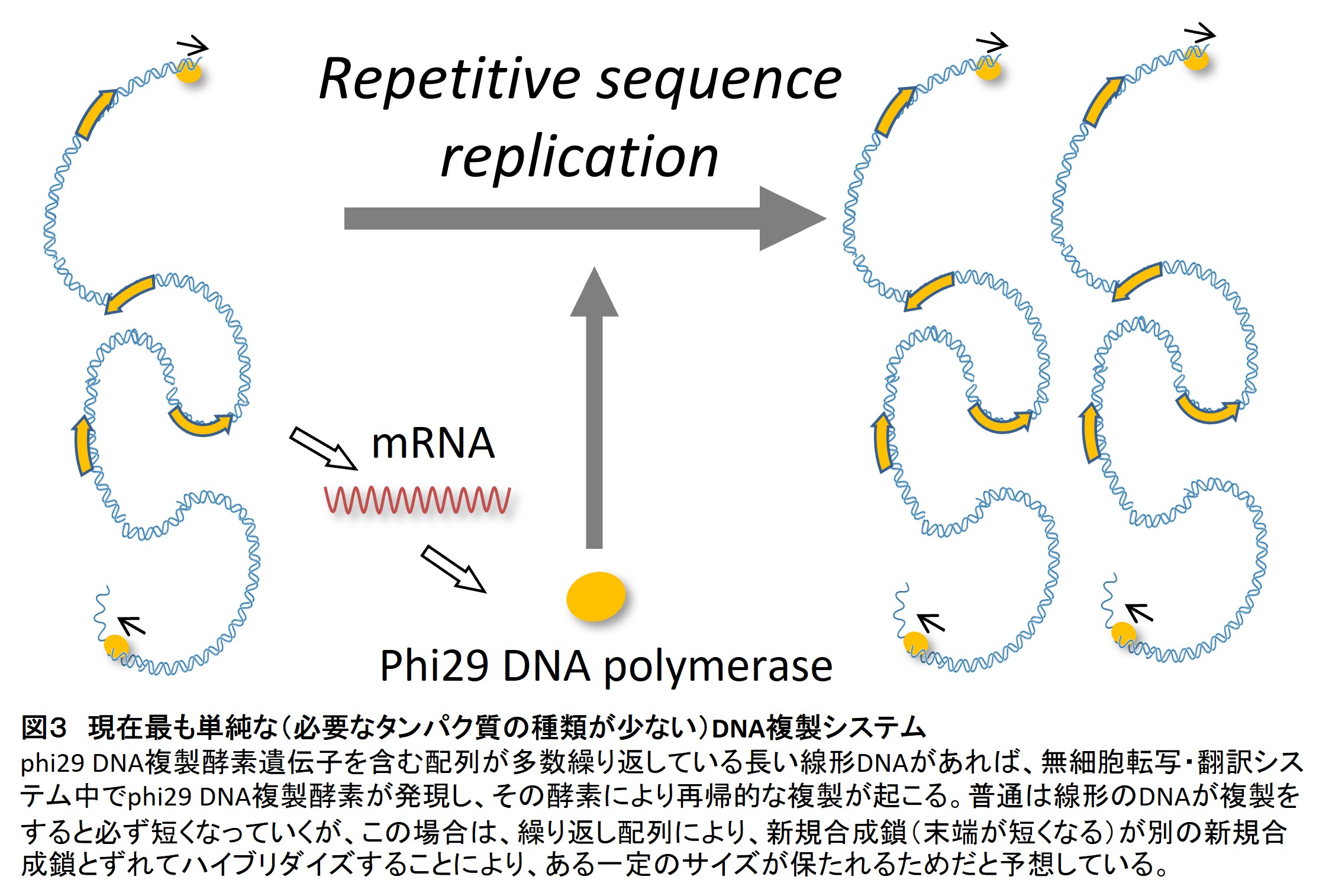
この構築過程では、さらに組み替え酵素も不要でDNA複製酵素のみで再帰的にDNA複製ができる新しい複製スキーム(repetitive sequence replication)も発見しました(図3)。これは偶然発見したことですが、再環状化がおきなくても直鎖状の繰り返しのあるDNAさえあれば、phi29 DNA polymeraseにより持続的な複製がおきるのです(2)。これはただ1つのタンパク質があれば持続的なDNA複製が達成できるということを示しており、その単純さから原始的なDNA複製の形かもしれないと考えています。
転写・翻訳と共役したDNA複製システムの進化実験
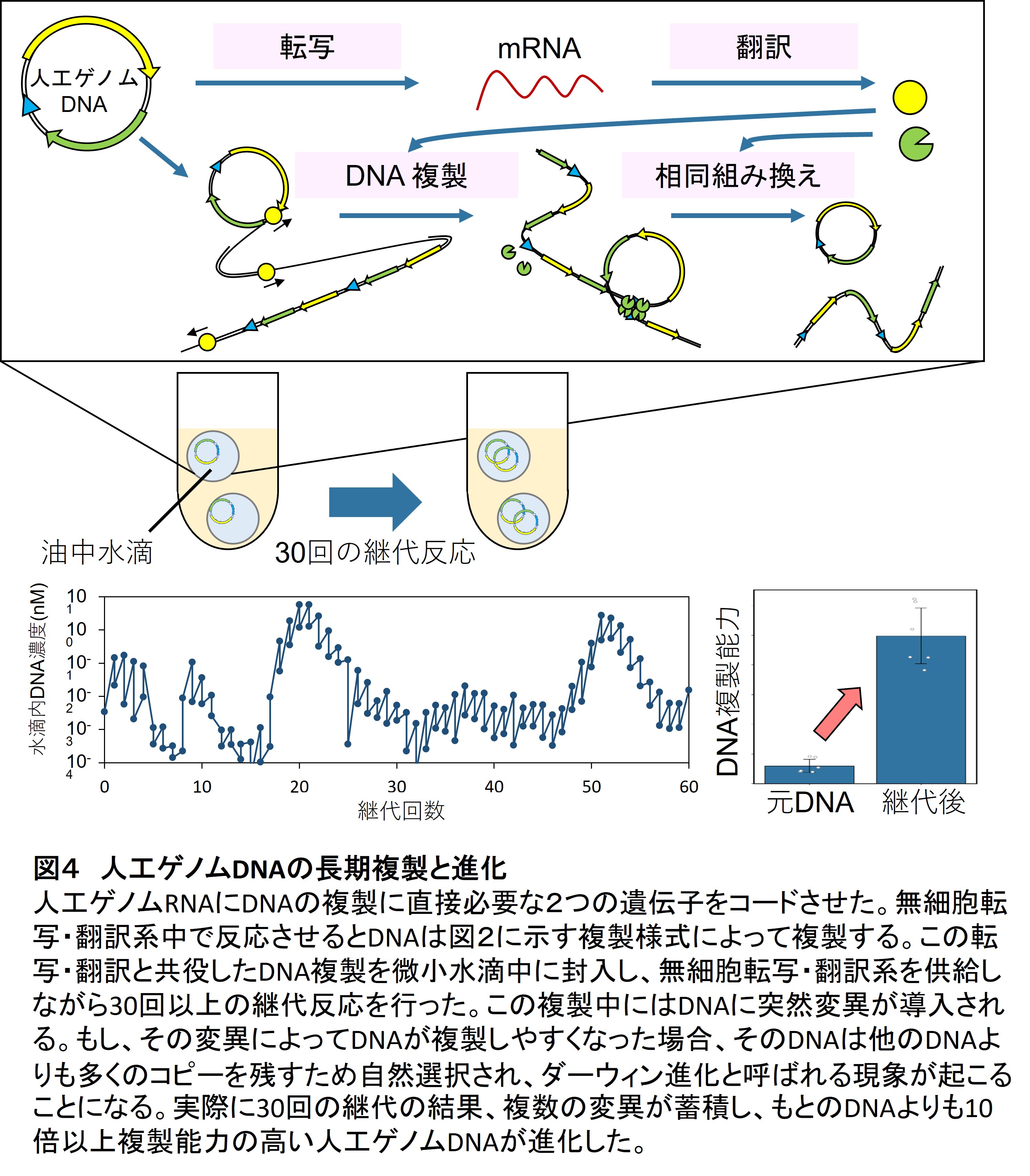
以上の2つのDNA複製スキームを使うと、人工ゲノムDNAは自身にコードした遺伝子の情報を使って自身を複製することになります。このような複製反応を続けると時々複製ミスにより突然変異が導入されます。さらにこの複製反応を微小区画中で続けると、複製に有益な変異が導入されたDNAが進化するはずです。私たちは油中水滴からなる微小区画を使い、複製を60回継代することによってこれを確かめました(3)。その結果、確かに複数の変異が導入され複製効率の高いDNAが進化することを見出しました(図4)。これは細胞の外でDNAが自身にコードした遺伝子を使って複製し進化した世界で初めての例になります。興味深いことに導入された変異には点変異だけではなく、プロモーター配列の挿入が頻繁にみられました。なぜプロモーターが増えるのかは今後明らかにしていきたいと考えています。
20種類のアミノアシルtRNA合成酵素の自己再生産とDNA複製
上記の自己複製する人工ゲノムDNAに別の遺伝子をコードさせておけば、それを発現させながらDNA自身も複製し続けることができます。コードさせる遺伝子を転写や翻訳に必要な遺伝子にしておけば、転写翻訳に必要なタンパク質を作りながら転写翻訳をし続けることができるようになります。このような自己再生産反応が全ての必要な遺伝子について行えば、増えるセントラルドグマを達成できます。
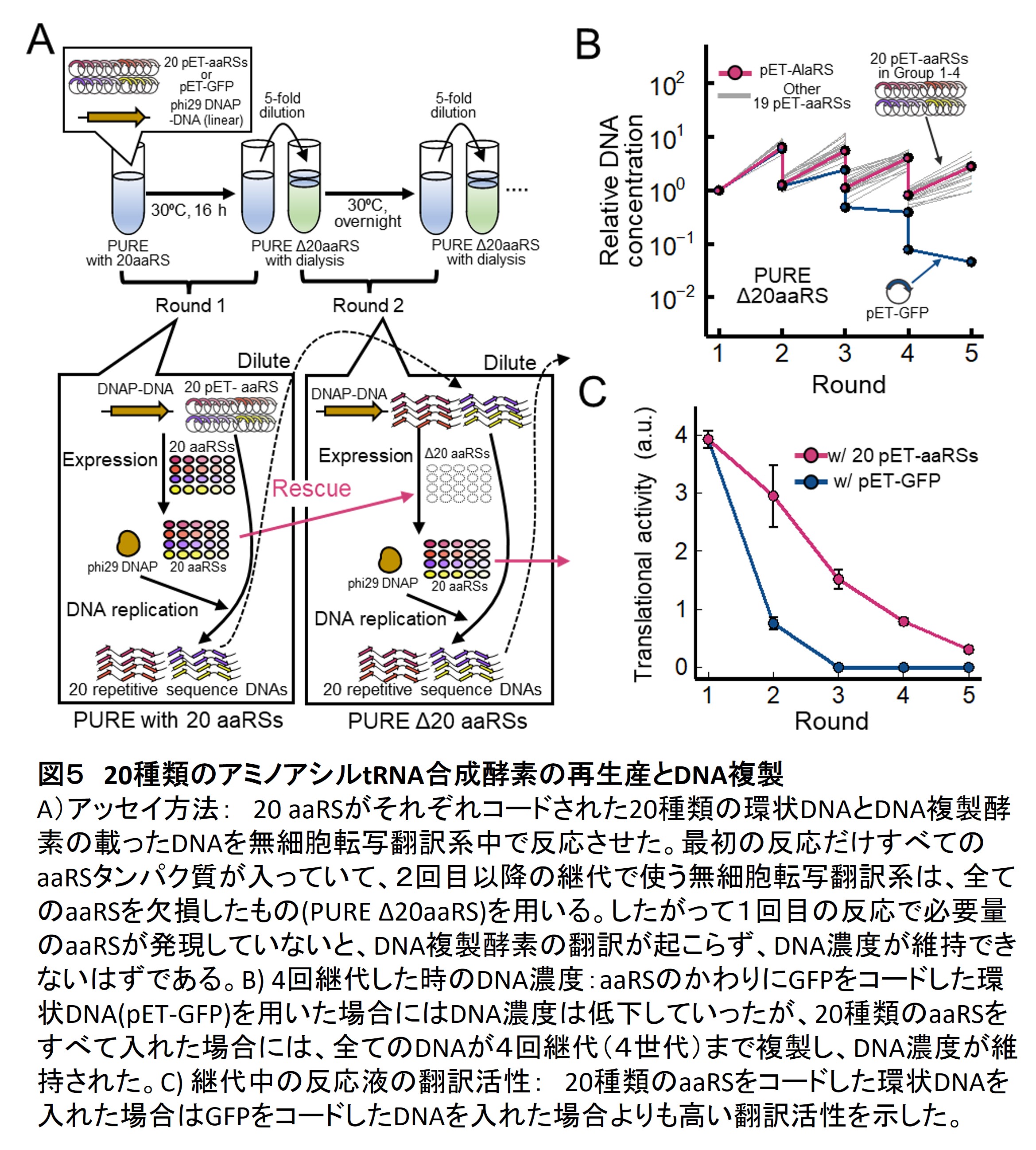
私たちはまず最初の試みとして翻訳反応に必須な20種類のアミノアシルtRNA合成酵素(aaRS)遺伝子を人工ゲノムDNAに組み込んで遺伝子発現を行いながらDNA複製も続けることを行いました。配列や反応系のいろいろな最適化が必要でしたが最終的には20種類全てのaaRSについての再生産とDNA複製を4世代続けることに成功しました(4)。先行研究では7個程度の翻訳遺伝子しか再生産できていなかったことを考えると、この成果は増殖する人工分子システムへ向けた大きな前進だと考えています(図5)。ただし、翻訳活性自体は世代が進むにつれて低下してしまっており、なにかしらのaaRSの発現量が足りないことが予想されます。この問題を解決し、持続的な翻訳活性を維持することが次の課題です。
15種類のtRNAの再構成無細胞翻訳系中での合成とDNA複製
翻訳反応にはタンパク質だけではなく少なくとも21種類のtRNA(トランスファーRNA)が必要です。しかし、細胞内で行われている方法でtRNAを作るには多数の化学修飾や多段階のプロセシングが必要であり、試験管中で再現することは未だ困難です。そこで私たちは、Hibiらの開発した21種類の修飾が不要なtRNAセット(5)を使って、これらをDNAにコードさせて再構成無細胞翻訳系中で合成することを試みました。またプロセシングを不要とするためにtRNA末端から末端までを直接転写する方法を用いました。この方法により、21種類中15種類のtRNAについて再構成無細胞翻訳系中で活性のある形で合成することに成功しました(7)。さらにそのうち一つのtRNAについては環状DNAから発現させ、上記のDNA複製方法により複製することにも成功しています(図6)。今後残りの6種類のtRNAについても合成できるようにすれば、全てのtRNAを再生産しながら翻訳反応を行うことができるようになります。
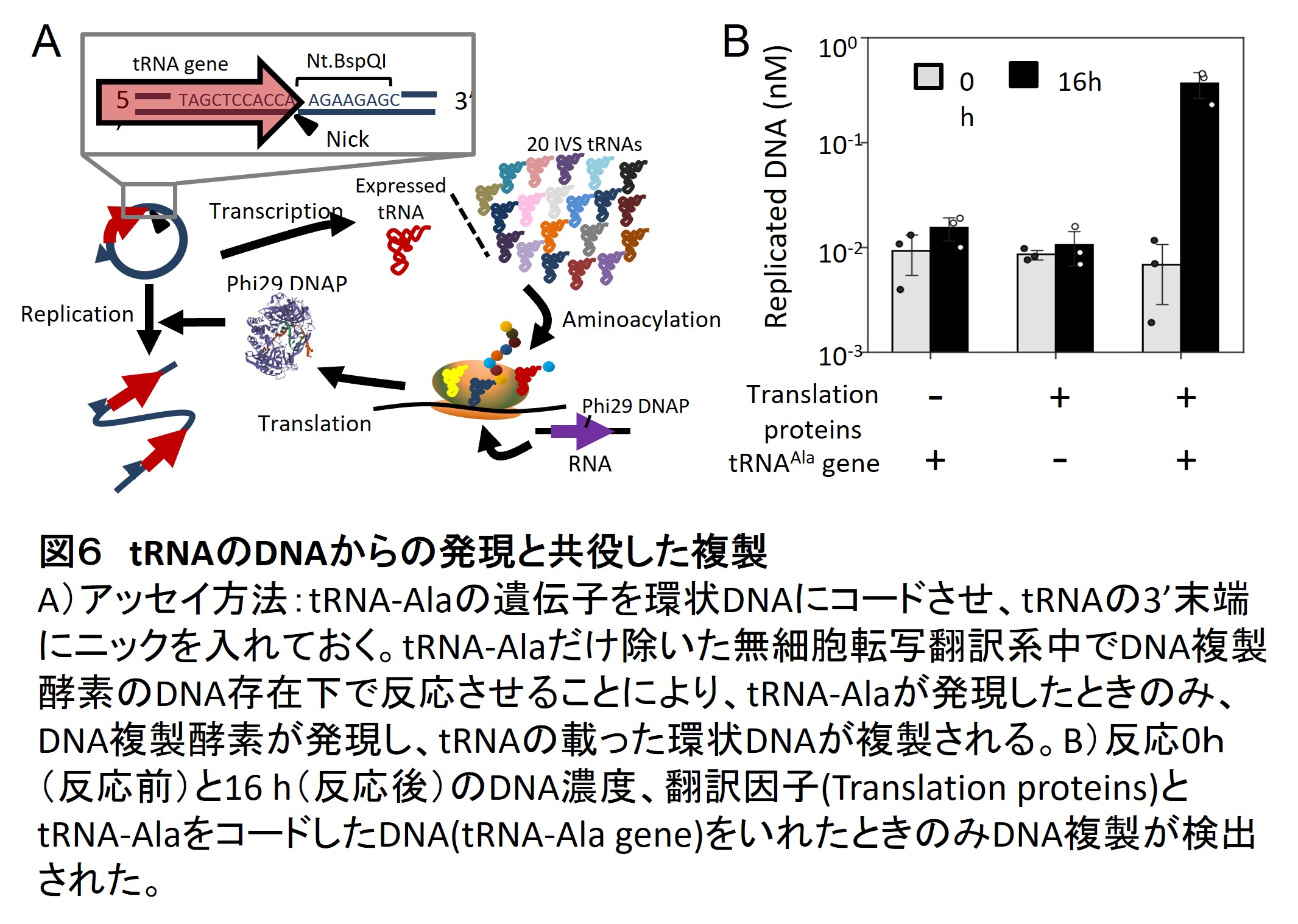
DNA複製、転写、翻訳反応のコンパチビリティの解析
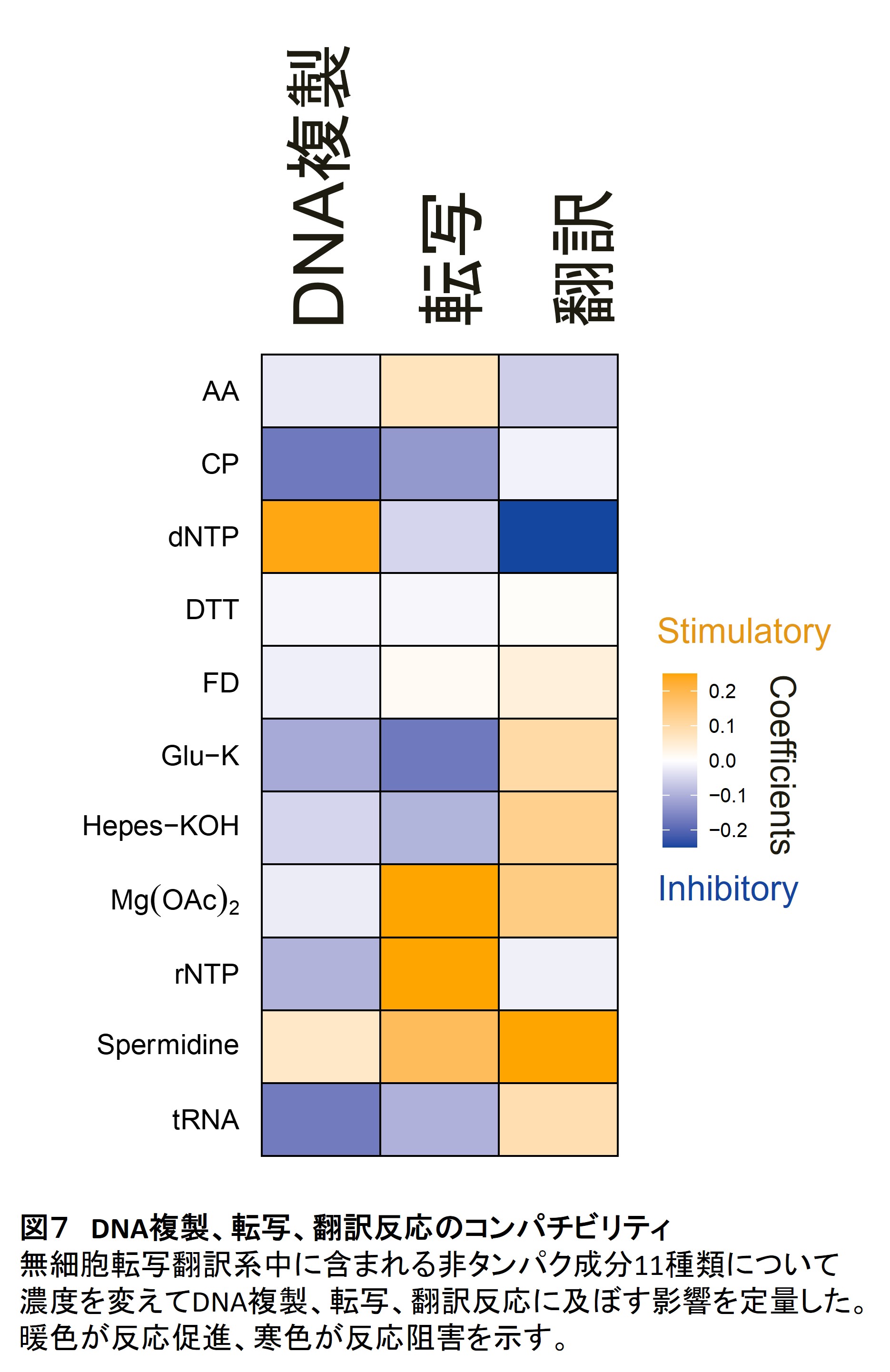
セントラルドグマを試験管内の中で再構成するには、セントラルドグマを構成する3つの反応(DNA複製、転写、翻訳)のすべてを同じ環境で同時に行う必要があります。細胞の中ではこの3つは(原核生物では)同じ環境で同時に起こっているので、当初、この3つの反応を組み合わせることは特に難しいことではないだろうと考えていたのですが、実際にやってみると単独では上手く反応するのに組み合わせると上手くいかなくなることが頻繁に起きました。例えば、反応液の成分を調整してDNA複製の効率を上げると逆に翻訳が下がったり、反対に翻訳を上げると今度はDNA複製が落ちたりするのです。こうした結果はこの3つの反応は共存しにくい(コンパチブルではない)ことを示唆しています。
しかし、この問題を解決して、3つの反応を全て効率良く行わせないと効率のよいセントラルドグマは達成できません。そこで私たちは、この問題をシステマティックに解析するために、反応液中に含まれる全ての低分子量成分11種類について、どの成分がどの反応にどんな影響を及ぼしているのかを網羅的に調べました。その結果、例えばヌクレオチド(dNTP, NTP)やtRNAがDNA複製と翻訳に真逆の影響を及ぼしていることを明らかにしました(6)(図7)。このうちヌクレオチドの効果については、マグネシウムイオン濃度の調整により部分的に緩和されることを見出しました。そして最適なマグネシウムイオン濃度を調整することにより、DNA複製をある程度維持したまま、転写と翻訳活性を大きく上げることに成功しています。
そのほかの応用例
以上の研究は、将来(おそらく10年以上先)の未来を見据えたものですが、もっと近々の応用を目指した研究も行っています。
例えば、現在までに得られた成果は以下のようなものがあります。
- 高活性なDNA複製酵素変異体の開発
- 二酸化炭素固定をおこなう人工細胞の開発
微量のDNAを増幅する技術は、血中のがん細胞由来のDNAの検出や、環境中の有用遺伝子の探索、あるいは腸内微生物環境の測定のために重要な技術となっています。これまでに様々な技術が開発されてきましたが、私たちは人為進化によって今までよりも桁違いに高活性なDNA複製酵素を開発しました(7)。
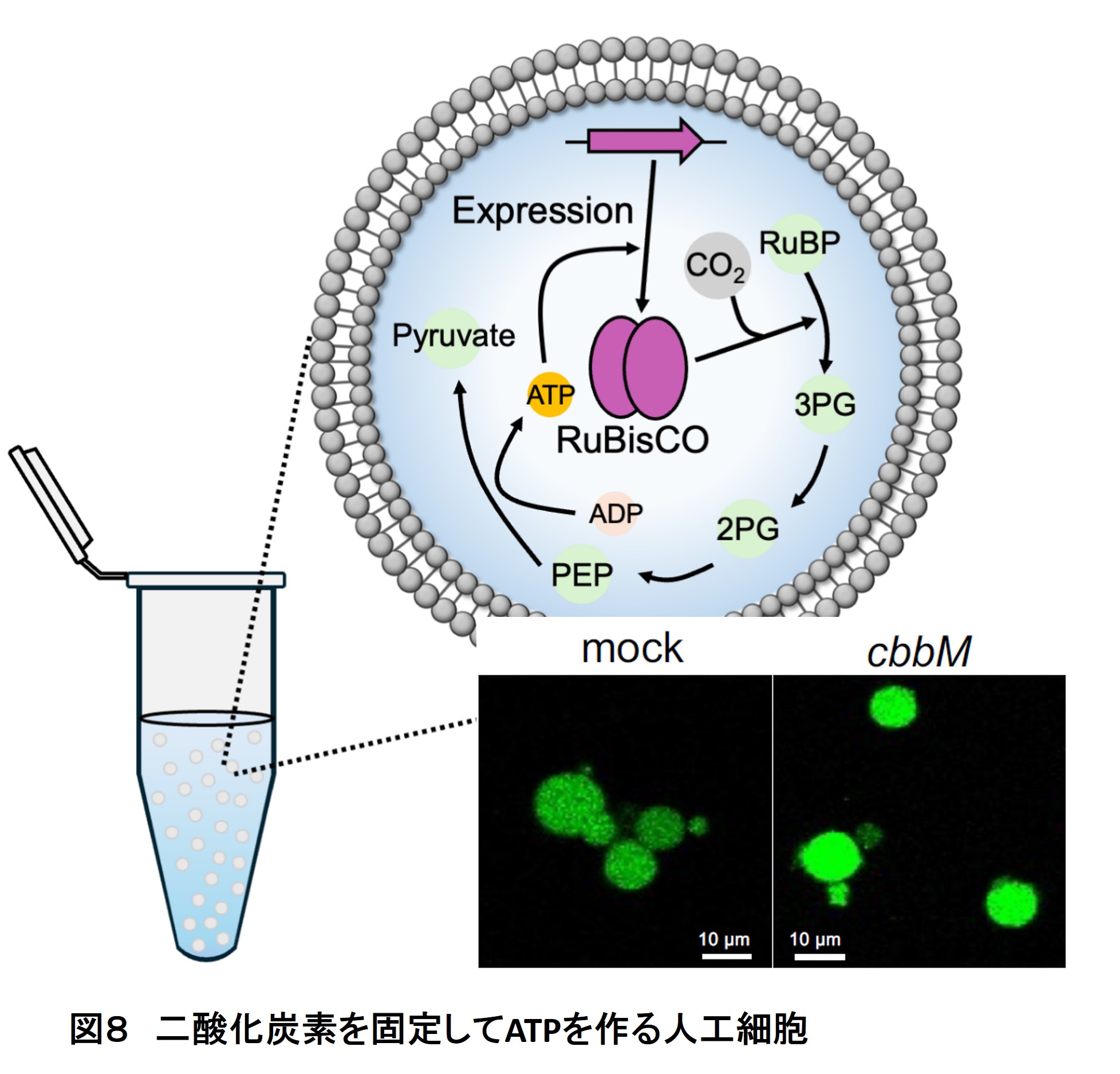
RuBisCOは大気中の二酸化炭素を固定する主要な酵素ですが、その活性は改良の余地があると言われています。これまでに変異導入による改良や、微生物を使った進化工学による改良が行われてきましたが、活性の大幅な改善には至っていません。私たちは最近、細菌型のRuBisCOを再構成型無細胞翻訳系で発現させATP合成を行うことに成功しました(8)。この反応と私たちの進化技術を組み合わせれば、完全に無細胞でのRuBisCOの進化工学が可能になります。無細胞環境では天然ではありえない条件(CO2, O2濃度など)での進化実験が可能なことから、天然型よりも高活性なRuBisCOを人為進化させられ、大気中の二酸化炭素削減に貢献できるのではないかと考えています。
参考文献(すべて当研究室からの論文)
- Sakatani, Y., Yomo, T., Ichihashi, N.*, Self-replication of circular DNA by a self-encoded DNA polymerase through rolling-circle replication and recombination., Sci Rep 8, 13089 (2018)
- Okauchi, H., Sakatani,Y., Ohtsuka, K., Ichihashi, N.*, Minimization of elements for isothermal DNA replication by an evolutionary approach, ACS Synthetic Biology 9, 1771-1780 (2020)
- Okauchi, H., Ichihashi, N.* Continuous cell-free replication and evolution of artificial genomic DNA in a compartmentalized gene expression system, ACS Synthetic Biology, 10, 3507-3517 (2021)
- Hagino, K., Ichihashi, N.* In vitro transcription/translation-coupled DNA replication through partial regeneration of 20 aminoacyl-tRNA synthetases, ACS Synthetic Biology, 12, 1252–1263 (2023)
- Miyachi, R., Shimizu, Y., Ichihashi, N.*, Transfer RNA Synthesis-Coupled Translation and DNA Replication in a Reconstituted Transcription/Translation System, ACS Synthetic Biology, 11, 2791–2799 (2022)
- Seo, K., Ichihashi, N.*, Investigation of Compatibility between DNA Replication, Transcription, and Translation for in Vitro Central Dogma, ACS Synthetic Biology, 12, 1813–1822 (2023)
- Sakatani,Y., Mizuuchi, R., Ichihashi, N.*, In vitro evolution of phi29 DNA polymerases through compartmentalized gene expression and rolling-circle replication, Protein Engineering Design and Selection, 32, 481-487 (2019)
- Sugii, S.+, Hagino, K.+, Mizuuchi, R., Ichihashi, N.* (+ equally contributed), Cell-Free Expression of RuBisCO for ATP Production in the Synthetic Cells, Synthetic Biology 8, ysad016 (2023)
世界での立ち位置
本研究のように生物の持つ機能を試験管内で既知の分子から再構成する試みは、in vitro合成生物学、人工細胞合成などと呼ばれ、最近特に盛り上がっています。アメリカ、ヨーロッパで大型プロジェクトや研究組織が立ち上がり始めています。実はこの分野は日本が先行しており、10年以上前に「細胞をつくる研究会」http://jscsr.org/が発足し、多くの先進的な研究がなされています(注2)。私たちの研究に関しても、遺伝子発現に共役したDNA複製と進化を試験管内で起こすことができたのは世界でも私たちのグループのみであり、現状で世界をリードしていると言っても過言ではありません。このまま研究を続けて、十数年後には「増える人工細胞」という新しいバイオテクノロジーを生み出したいと考えています。
注2: 研究分野で日本が先行するのは珍しいことのように思います。なぜ先行できたのかを考えてみるに、この分野の研究が日本人の好みに合っているからのような気がしています。この分野では、多種多様なタンパク質やRNAの性質を理解して、一つの機能を達成できるように組み立てていきます。いわば分子レベルのものづくりです。そこには経験がものを言いますし、結構職人技が必要だったりします。条件検討も細かくやらないとまともに動かないことも多くあります。こういうちまちました作業が苦にならない(むしろ好き)な人に向いている研究だと思います。
これからやりたいこと
自律的に増えるセントラルドグマへ
以上の研究により、ゲノムDNAがDNA複製に直接必要な遺伝子を自ら発現しながら持続的に複製する人工システムを作ることができました。あとは、遺伝子の転写と翻訳に必要な遺伝子群をこのDNAにコードさせていくことにより、増えるセントラルドグマができるはずです。現在、以下の研究プロジェクトを進めています。
- DNA複製に直接必要なすべての遺伝子をコードし、それらを発現しながら複製する人工ゲノムDNAの開発
- 転写遺伝子をコードし、それらを発現しながら複製する人工ゲノムDNAの開発
- アミノアシルtRNA合成酵素遺伝子をコードし、それらを発現しながら複製する人工ゲノムDNAの開発
- tRNA遺伝子をコードし、それらを発現しながら複製する人工ゲノムDNAの開発
- 試験管内で転写したRNAからのリボソームの再構成
DNA複製システムの進化
上でい一応、持続的に複製可能な人工DNA複製システムを構築しましたが、天然のDNA複製システムに比べると副産物が多く、複製も遅く、お世辞にもよくできているとは言えません(ただ単純さだけは圧倒的に勝っています)。幸い進化させることができるようになったので、この人工ゲノムDNAを長期継代しDNA複製にかかわる遺伝子を進化させたいと思っています。いったいどう進化するでしょうか? これは原始的なDNA複製からどうやって現代的なDNA複製が進化したのかを解き明かす知見をもたらすと期待しています。
この研究で身につくこと
もし、大学院、あるいは博士研究員として上記のような研究をした場合、人工細胞技術全般(DNA、RNA、タンパク質の合成、精製、取り扱い方法、トラブルシューティング方法)が身につくはずです。次の世代では人工細胞技術は最重要技術の一つとなるとなるはずです。この次世代バイオテクノロジーの中核を担うような人材になることができるでしょう。
またもう少し実用的な技術として、この研究室で博士号をとった人には再構成無細胞翻訳系(PURE system)の調整方法を伝授する仕組みを作ろうとしています。人工細胞をつくるための中核となるのは再構成無細胞翻訳系です。これを自分で作ることができれば、研究の幅が大きく広がります。高額な機械や試薬を使うことなく、数年以内には、妥当な労力でこの再構成無細胞翻訳系を調整する方法を伝えられるようにしたいと考えています。
それ以外にも上記のテーマを実施しることにより、難しい問題を分解し、一つ一つ解決していく能力が身に付きます。in vitroで何かの機能を組み立てる場合、いきなりうまくいくことはまずありません。もし、うまくいったとしたら多分それは多分違うものを測ってしまっています。たいていうまくいかないので、どこまでうまくいっているかを多数のコントロール実験により一つ一つ潰していく作業になります。そこで培われるのは根気と注意力と高い実験技術です。これは卒業後にどんな研究に携わるのであれ、研究以外の仕事をするのであれ、大きな力となってくれるはずです。
詳しくはこちら
