研究内容
プロジェクト3−2(2)
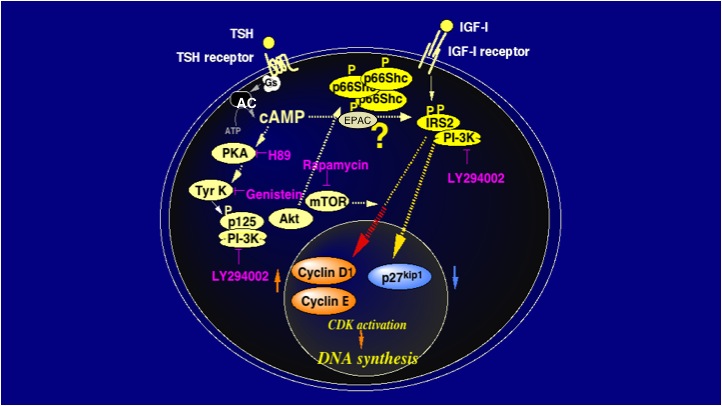
先にも述べたように、内分泌細胞の増殖・分化、細胞死、細胞機能は、トロピックホルモンとIGFの相互作用で調節されています。私たちは、ラット甲状腺由来正常細胞FRTL-5を甲状腺刺激ホルモン(TSH)とIGF-Iで処理することにより、細胞機能や細胞増殖が相乗的に増強されることを見出しました。この際、タンパク質合成を指標とした細胞機能は、IGF-I長時間前処理後TSHで処理することにより増強され、一方、DNA合成を指標とした細胞増殖は、あらかじめcAMP情報伝達経路を長時間刺激することによりIGF-I依存性細胞増殖が相乗的に増強される、すなわち、cAMP前処理で細胞がIGF-Iにより応答するようにprimingされることを見出しました。
一般に、細胞周期の進行は、cyclin/cyclin-dependent kinase(CDK)/ CDK inhibitor(CKI)など細胞周期制御タンパク質の活性変動によって緻密に調節されていることが明らかにされてきています。この細胞ではcAMP前処理時間依存的にcyclin D1あるいはEといったG1期の進行に必須であるG1 cyclinがわずかに増加しますが、その後のIGF-I処理によって相乗的にこれらのタンパク量が増加することが明らかとなりました。また、cAMP前処理後にIGF-I処理を行った場合にのみ、CKIのひとつであるp27KIP1の相乗的な減少が観察されました。G1 cyclinの増加とCKIの減少を反映して、CDKが著しく活性化され、RbなどのS期進行に必要な転写因子を活性化する結果、細胞周期がG1期からS期へ進行することがわかりました 。
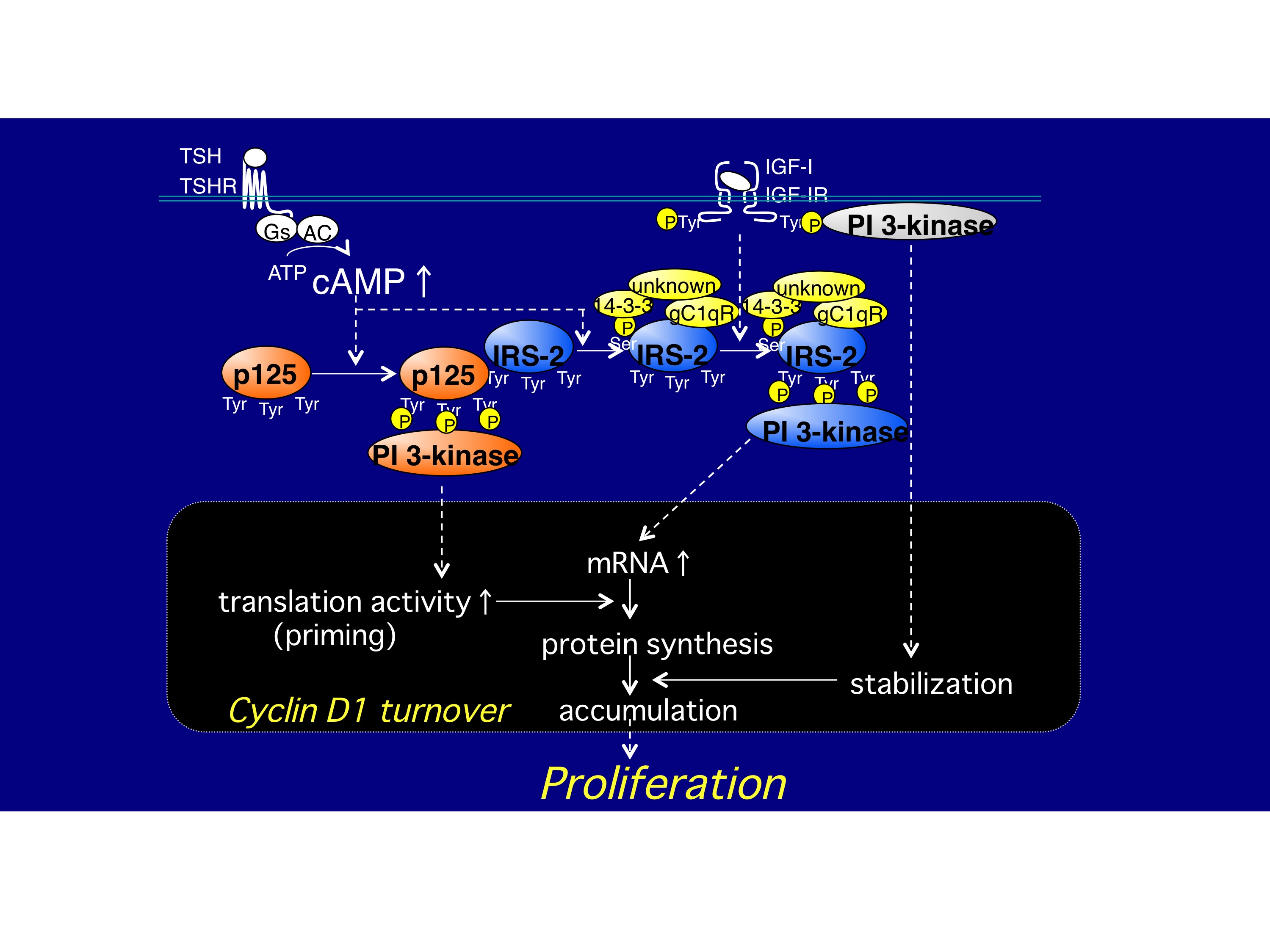
このG1 cyclinの増加とCKIの減少には、少なくとも二つのシグナル経路の活性化が重要な役割を果たしていることを私たちは見つけました。まず、cAMP経路の長期刺激によりp125という新しいシグナル分子がチロシンリン酸化され、これを認識して結合するPI3Kが活性化される経路、更に、cAMP経路の長期刺激によりIGF-Iレセプター基質のひとつIRS-2のIGF-I依存性チロシンリン酸化が増強され、チロシンリン酸化IRS-2を認識して結合するPI3Kが活性化する経路、これらの両経路の活性化を介して、G1 cyclinの増加、CKIであるp27kip1の分解が起こります 。
この際のcyclin D1の増加機構を更に詳しく調べたところ、「cAMP長期刺激によりIRS-2にセリン/スレオニンリン酸化が起こり、更にIRS-2に複数種のタンパク質が相互作用、その結果IRS-2はIGF-Iレセプターキナーゼにチロシンリン酸化されやすくなる、そしてチロシンリン酸化されたIRS-2は相互作用するPI3Kを相乗的に活性化し、cyclin D1の転写を促進する結果、mRNA量が増加する。チロシンリン酸化p125と相互作用するPI3Kはcyclin D1の翻訳活性を増加させ、cyclin D1を合成する。そして、IGF-Iレセプターと相互作用しているPI3Kにより、合成されたcyclin D1が安定化される」、その結果、cyclin D1が高いレベルで維持されていることが明らかとなりました 。
既にp125の同定に成功し、このタンパク質をPITKAP(PI Three-Kinase-Associated Protein)と名付けました。このような緻密な機構は甲状腺細胞だけではなく、IGFに依存した内分泌細胞の増殖誘導に共通した機構であることも徐々に明らかになりつつあります。
| 研究内容:目次 | プロジェクト3−2(1) 戻る 次へ プロジェクト3−2(3) |